Chirální rozlišení
Chirální rozlišení (též se označuje jako optické nebo enantiomerní rozlišení[1]) je stereochemický proces, při kterém se z racemické směsi oddělují jednotlivé enantiomery.[2] Využití nachází při přípravě opticky aktivních látek, jako jsou například léčiva.[3]
Použití chirálního rozlišení k získání enantiomerně čisté sloučeniny má nevýhodu v odstranění velké části původní racemické směsi; tomu se lze vyhnout pomocí asymetrické syntézy.
Krystalizace diastereomerních solí
Nejčastěji používaným způsobem chirálního rozlišení je přeměna složek racemátu na dva diastereomerní deriváty jejich reakcemi s chirálním derivatizačním činidlem; takto vytvořené deriváty je již možné oddělit krystalizací a přeměnit na původní enantiomery. Výsledek procesu ovlivňují rozdílné rozpustnosti diastereomerů, které se často obtížně předvídají. Obvykle se jako cílová molekula využije méně rozpustný diastereomer a druhý se odstraní nebo racemizuje a vzniklý racemát použije znovu. Častým způsobem derivatizace je tvorba soli aminu a karboxylové kyseliny, kdy se poté jednoduchou deprotonací získá čistý enantiomer; takto se například využívá spojení kyseliny vinné a aminu brucinu. Tento postup použil v roce 1853 Louis Pasteur k optickému rozlišení racemické kyseliny vinné s použitím opticky aktivního (+)-cinchotoxinu.
Příklad
Chirální rozlišení se zapojuje do přípravy léčiva duloxetinu:[4]
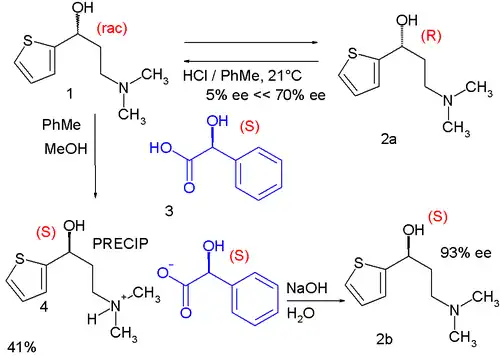
V jednom z kroků se racemický alkohol 1 rozpouští ve směsi toluenu a methanolu a do roztoku se přidává kyselina (S)-mandlová 3. (S)-enantiomer alkoholu vytváří nerozpustný diastereomer soli s kyselinou mandlovou, která se odfiltruje a deprotonací hydroxidem sodným se získá volný (S)-alkohol. (R)-alkohol zůstane v roztoku v nezměněné podobě a racemizuje se epimerizací kyselinou chlorovodíkovou v toluenu.
Příklady používaných činidel
- Vinan draselno-antimonitý, anion vytvářející s chirálními kationty diastereomerní soli[5]
- Kyselina kafrsulfonová, vytváří diastereomerní soli s chirálními aminy
- 1-fenylethylamin, zásada tvořící diastereomerní soli s chirálními kyselinami[6]
Dostupná je i řada dalších derivatizačních činidel.[7]
Samovolné rozlišení a podobné metody
U 5-10 % racemických směsí nastává samovolné rozlišení, kdy se samovolně vytvářejí enantiomerně čisté krystaly;[8] díky tomuto jevu mohl Louis Pasteur oddělit levotočivý vinan amonno-sodný od pravotočivého. V roce 1882 zkrystalizoval přesycený roztok této soli, přičemž se usadily d-krystaly na jedné straně reakční nádoby a l-krystaly na druhé.
Samovolné rozlišení bylo použito také u racemického metadonu.[9] 50 gramů dl-methadonu bylo rozpuštěno v petroletheru a roztok byl zakoncentrován. Do roztoku bylo přidáno po jednom milimetrovém krystalu d- a l-enantiomeru a po 125hodinovém míchání při 40 °C se vytvořily velké krystaly d- a l-metadonu, s výtěžností 50 %.
Lze také provést přednostní krystalizaci jednoho z enantiomerů; takto se například krystalizuje (−)-hydrobenzoin z ethanolového roztoku (±)-hydrobenzoinu.
Chirální sloupcová chromatografie
Při chirální sloupcové chromatografii se používají chirální stacionární fáze, s podobnými rozlišovacími činidly jako výše.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Chiral resolution na anglické Wikipedii.
- ↑ Reinhard Kuhn; Fritz Erni; Thomas Bereuter; Johannes Haeusler. Chiral recognition and enantiomeric resolution based on host-guest complexation with crown ethers in capillary zone electrophoresis. Analytical Chemistry. 1992-11-15, s. 2815–2820. doi:10.1021/ac00046a026.
- ↑ SMITH, Michael B.; MARCH, Jerry. Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. [s.l.]: Wiley-Interscience, 2007. 2250 s. Dostupné online. ISBN 978-0-471-72091-1. S. 173-179.
- ↑ William H. Porter. Resolution of chiral drugs. Pure and Applied Chemistry. 1991, s. 1119–1122. Dostupné online. doi:10.1351/pac199163081119.
- ↑ Yoshito Fujima; Masaya Ikunaka; Toru Inoue; Jun Matsumoto. Synthesis of (S)-3-(N-Methylamino)-1-(2-thienyl)propan-1-ol: Revisiting Eli Lilly's Resolution-Racemization-Recycle Synthesis of Duloxetine for Its Robust Processes. Organic Process Research & Development. 2006, s. 905–913. doi:10.1021/op060118l.
- ↑ F. P. Dwyer; F. L. Garvan. Resolution of cis -Dinitrobis(ethylenediamine)cobalt Ion. Inorganic Syntheses. 1960, s. 195–197. Dostupné online. ISBN 978-0-470-13237-1. doi:10.1021/op060118l.
- ↑ A. W. Ingersoll. D- and l-α-Phenylethylamine. Organic Syntheses. 1937, s. 80. doi:10.15227/orgsyn.017.0080.
- ↑ J. Jacques; C. Fouquey. Enantiomeriic (S)-(+)- and (R)-(−)-1,1'-Binaphthyl-2,2'-diyl Hydrogen Phosphate. Organic Syntheses. 1989. doi:10.15227/orgsyn.067.0001.
- ↑ Jean Jacques; André Collet; Samuel H. Wilen. Enantiomers, racemates, and resolutions. [s.l.]: [s.n.], 1981. Dostupné online. ISBN 0-471-08058-6.
- ↑ Harold E. Zaugg. A Mechanical Resolution of dl-Methadone Base. Journal of the American Chemical Society. 1955, s. 2910. doi:10.1021/ja01615a084. Bibcode 1955JAChS..77.2910Z.
Literatura
- Roger Arthur Sheldon. Chirotechnology: industrial synthesis of optically active compounds. [s.l.]: Dekker, 1993. ISBN 978-0-8247-9143-8.