Chlorid cíničitý
| Chlorid cíničitý | |
|---|---|
_chloride.jpg) Bezvodý chlorid cíničitý | |
_chloride_pentahydrate.jpg) Pentahydrát chloridu cíničitého | |
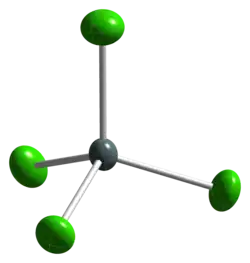 Model | |
| Obecné | |
| Systematický název | Chlorid cíničitý |
| Ostatní názvy | tetrachlorstannan |
| Anglický název | Tin(IV) chloride |
| Německý název | Zinn(IV)-chlorid |
| Sumární vzorec | SnCl4 |
| Vzhled | bezbarvá dýmavá kapalina bílé až nažloutlé krystalky (pod tt) |
| Identifikace | |
| Registrační číslo CAS | 7646-78-8 |
| EC-no (EINECS/ELINCS/NLP) | 231-588-9 |
| UN kód | 1827 |
| Číslo RTECS | XP8750000 |
| Vlastnosti | |
| Molární hmotnost | 260,50 g/mol 350,60 g/mol (pentahydrát) |
| Teplota tání | −33 °C |
| Teplota varu | 114,1 °C |
| Hustota | 2,226 g/cm3 2,04 g/cm3 (pentahydrát) |
| Dynamický viskozitní koeficient | 0,806 cP (30 °C) 0,725 cP (40 °C) 0,668 cP (50 °C) |
| Index lomu | nD = 1,512 |
| Kritická teplota Tk | 318,7 °C |
| Kritický tlak pk | 3 750 kPa |
| Kritická hustota | 0,742 g/cm3 |
| Rozpustnost ve vodě | reaguje dobře rozpustný (pentahydrát) |
| Rozpustnost v polárních rozpouštědlech | diethylether reaguje s alkoholy |
| Rozpustnost v nepolárních rozpouštědlech | kapalné uhlovodíky tetrachlormethan dioxan |
| Relativní permitivita εr | 3,104 (0 °C) 2,87 (20 °C) |
| Van der Waalsovy konstanty stavové rovnice | a= 2,727 Pa m6mol−2 b= 16,42×106 m3mol−1 |
| Měrná magnetická susceptibilita | −5,57×10−6 cm3g−1 |
| Struktura | |
| Krystalová struktura | jednoklonná |
| Hrana krystalové mřížky | a = 985 pm b = 675 pm c = 998 pm β = 102°15' |
| Tvar molekuly | tetraedr |
| Dipólový moment | 0 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −545,3 kJ/mol |
| Entalpie tání ΔHt | 35,2 J/g |
| Entalpie varu ΔHv | 140,7 J/g |
| Standardní molární entropie S° | 258,6 JK−1mol−1 |
| Standardní slučovací Gibbsova energie ΔGf° | −474,2 kJ/mol |
| Izobarické měrné teplo cp | 0,635 JK−1g−1 |
| Bezpečnost | |
 GHS05 Nebezpečí[1] | |
| R-věty | R34, R52/53 |
| S-věty | (S1/2), S7/8, S26, S45, S61 |
| NFPA 704 |  0
3
1
|
Některá data mohou pocházet z datové položky. | |
Chlorid cíničitý je bezbarvá kapalná látka, jejíž výpary při kontaktu se vzduchem dýmají směsí chlorovodíku a oxidu cíničitého. Tento jev je způsoben hydrolýzou chemikálie vlhkostí ve vzduchu. Dým je toxický, silně leptá sliznice a má velmi nepříjemný ostrý zápach. Jde, společně s chloridem cínatým, o jeden z chloridů cínu. Cín má zde oxidační číslo +IV, chlór má oxidační číslo -I.
Výroba
Chlorid cíničitý se průmyslově vyrábí reakcí cínu s plynným chlórem.
|
|
Tuto látku je možno vyrobit z koncentrované kyseliny chlorovodíkové a cínu, avšak vzniká větší či menší množství chloridu cínatého, podle schématu:
|
|
Při reakci vzniká jen malé množství chloridu cíničitého, proto tato reakce nemá praktické využití. Laboratorně lze tuto látku vyrobit reakcí chloridu cínatého s oxidačními činidly, lze použít například chlorid železitý.
|
|
Lze použít i jiná činidla.
Reakce
Bezvodý chlorid cíničitý je silnou Lewisovou kyselinou. S kyselinou chlorovodíkovou reaguje za vzniku aniontu [SnCl6]2−, který vytváří kyselinu hexachlorcíničitou H2[SnCl6].
Použití
V první světové válce byl používán jako nesmrtící chemická zbraň, jelikož jeho výpary při kontaktu se vzduchem vytváří nepříjemný kouř. Ke konci války byl nahrazen směsí chloridu křemičitého SiCl4 a chloridu titaničitého TiCl4.
Tato látka se využívá na výrobu organocíničitých solí.
Odkazy
Reference
- ↑ a b Tin tetrachloride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid cíničitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid cíničitý na Wikimedia Commons