Chlorid niobičitý
| chlorid niobičitý | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | Chlorid niobičitý |
| Anglický název | Niobium(IV) chloride |
| Německý název | Niob(IV)-chlorid |
| Sumární vzorec | NbCl4 |
| Vzhled | černofialové krystaly |
| Identifikace | |
| Registrační číslo CAS | 13569-70-5 |
| PubChem | 83583 |
| SMILES | Cl[Nb](Cl)(Cl)Cl |
| InChI | InChI=1S/4ClH.Nb/h4*1H;/q;;;;+4/p-4
Key: FCLAPXQWWIRXCV-UHFFFAOYSA-J |
| Vlastnosti | |
| Molární hmotnost | 234,7 g/mol |
| Teplota tání | 800 °C (rozkládá se) |
| Teplota sublimace | 275 °C |
| Hustota | 3,14 g/cm3 |
| Rozpustnost ve vodě | reaguje s vodou |
| Struktura | |
| Krystalová struktura | jednoklonná |
| Hrana krystalové mřížky | a = 1232 pm
b = 682 pm c = 821 pm β = 134° |
Některá data mohou pocházet z datové položky. | |
Chlorid niobičitý je anorganická sloučenina s chemickým vzorcem NbCl4.
Příprava
Chlorid niobičitý se obvykle připravuje redukcí krystalického chloridu niobičného kovovým niobem. Reakce probíhá po dobu několika dní, kdy kov se přitom udržuje při teplotě okolo 400 °C a sůl při teplotě kolem 250 °C.[1]
- 4 NbCl5 + Nb → 5 NbCl4
Chlorid niobičitý lze také připravit redukcí chloridu niobičného pomocí práškového hliníku:
- 3 NbCl5 + Al → 3 NbCl4 + AlCl3
Podobný postup se používá i při syntéze bromidu tantaličitého nebo bromidu niobičitého. Jodid niobičitý je možné připravit tepelným rozkladem jodidu niobičného.
Při teplotě 400 °C dochází k disproporcionaci chloridu niobičitého:
- 2 NbCl4 → NbCl3 + NbCl5
Vlastnosti
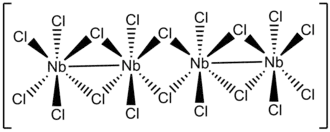
Chlorid niobičitý tvoří černofialové krystaly ve tvaru jehliček. Je diamagnetický, velmi citlivý na vzduch a rozpustný ve malém množství vody nebo ve zředěné kyselině chlorovodíkové za vzniku tmavě modrého zabarvení. Krystalizuje v jednoklonné soustavě s prostorovou grupou C2/m (číslo 12) a parametry mřížky a = 1232 pm, b = 682 pm, c = 821 pm, β = 134°.[2] Sloučenina se vyskytuje ve formě oktaedrů NbCl2Cl4/2.[3]
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Niobium(IV) chloride na anglické Wikipedii a Niob(IV)-chlorid na německé Wikipedii.
- ↑ MCCARLEY, Robert E.; TORP, Bruce A. The Preparation and Properties of Niobium(IV) Compounds. I. Some Niobium(IV) Halides and their Pyridine Adducts. Inorganic Chemistry. 1963-06, roč. 2, čís. 3, s. 540–546. Dostupné online [cit. 2025-06-28]. ISSN 0020-1669. doi:10.1021/ic50007a029. (anglicky)
- ↑ BRAUER, Georg. Handbuch der präparativen anorganischen Chemie. [s.l.]: Enke 732 s. Dostupné online. ISBN 978-3-432-87823-2. S. 1444. (německy)
- ↑ ALSFASSER, Ralf. Moderne anorganische Chemie: mit CD-ROM. [s.l.]: de Gruyter 902 s. Dostupné online. ISBN 978-3-11-019060-1. S. 349. (německy)
Externí odkazy
 Obrázky, zvuky či videa k tématu chlorid niobičitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlorid niobičitý na Wikimedia Commons