Dimethoxymethan
| Dimethoxymethan | |
|---|---|
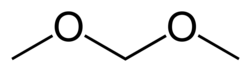 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | dimethoxymethan |
| Funkční vzorec | CH3OCH2OCH3 |
| Sumární vzorec | C3H8O2 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 109-87-5 |
| EC-no (EINECS/ELINCS/NLP) | 203-714-2 |
| PubChem | 8020 |
| ChEBI | 48341 |
| SMILES | COCOC |
| InChI | InChI=1S/C3H8O2/c1-4-3-5-2/h3H2,1-2H3 |
| Číslo RTECS | PA8750000 |
| Vlastnosti | |
| Molární hmotnost | 76,094 g/mol |
| Teplota tání | −105 °C (168 K)[1] |
| Teplota varu | 42 °C (315 K)[1] |
| Hustota | 0,86 g/cm3[1] |
| Rozpustnost ve vodě | 33 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu a ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu a diethyletheru[1] |
| Tlak páry | 42,6 kPa (20 °C)[1] |
| Bezpečnost | |
 GHS02  GHS07 | |
| H-věty | H225 H315 H319 H335[1] |
| P-věty | P210 P233 P240 P241 P242 P243 P261 P264 P264+265 P271 P280 P302+352 P303+361+353 P304+340 P305+351+338 P319 P321 P332+317 P337+317 P362+364 P370+378 P403+233 P403+235 P405 P501[1] |
| Teplota vzplanutí | −32 °C (241 K)[1] |
Některá data mohou pocházet z datové položky. | |
Dimethoxymethan je organická sloučenina patřící mezi ethery (jde o dimethylacetal formaldehydu), bezbarvá kapalina s nízkou viskozitou, používaná jako rozpouštědlo. Je rozpustný ve vodě a mísitelný s většinou běžných organických rozpouštědel.
Výroba a struktura
Tato látka se může vyrobit oxidací methanolu nebo reakcí formaldehydu s methanolem. Ve vodných roztocích kyselin se zpětně hydrolyzuje na formaldehyd a methanol.
Vzhledem k anomernímu efektu u dimethoxymethanu převládá židličková konformace namísto anti konformace vůči vazbám C-O. Vzhledem k tomu, že se v molekule nachází dvě vazby C–O, tak je nejstabilnější konformací židlička-židlička, s energií přibližně o 30 kJ/mol nižší než anti-anti, kde židlička-anti a anti-židlička tvoří průměr těchto energií.[2]
Protože se jedná o jednu z nejmenších molekul, u kterých se tento jev vyskytuje, tak se dimethoxymethan často používá v teoretických studiích zaměřeních na anomerní efekt a má tak význam v chemii sacharidů.
Použití
Průmyslově se dimethoxymethan využívá jako rozpouštědlo a jako výchozí látka při výrobě vůní, pryskyřic, lepidel a ochranných nátěrů. Dalším použitím je přidávání této látky do benzinu, kde zvyšuje oktanové číslo; dimethoxymethan se také přidává do motorových naft.[3]
V organické syntéze
Dimethoxymethan může také sloužit v organické syntéze k tvorbě methoxymethylových (MOM) chránicích skupin pro alkoholy.[4] Tyto skupiny se oobvykle vytvářejí reakcemi s oxidem fosforečným v dichlormethanu nebo chloroformu, což je postup upřednostňovaný před použitím chlormethylmethyletheru (MOMCl), který lze připravit jako roztok v methylesteru reakcí dimethoxymethanu a acylchloridu za přítomnosti katalyzátoru v podobě Lewisovy kyseliny, jako je například bromid zinečnatý:
- MeOCH2OMe + RC(=O)Cl → MeOCH2Cl + RC(=O)(OMe)
Roztok reaktantu je možné použít přímo bez přečišťování, což omezuje styk s karcinogenním chlormethylmethyletherem. Na rozdíl od postupu využívajícího formaldehyd a chlorovodík zde nevzniká vysoce karcinogenní vedlejší produkt bis(chlormethyl)ether.[5]
Odkazy
Externí odkazy
 Obrázky, zvuky či videa k tématu Dimethoxymethan na Wikimedia Commons
Obrázky, zvuky či videa k tématu Dimethoxymethan na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Dimethoxymethane na anglické Wikipedii.
- ↑ a b c d e f g h i j k l https://pubchem.ncbi.nlm.nih.gov/compound/8020
- ↑ Francis A. Carey; Richard J. Sundberg. Advanced organic chemistry. New York: Springer, 2007. ISBN 9780387448978.
- ↑ Krishna P. Shrestha, Sven Eckart, Ayman M. Elbaz, Binod R. Giri, Chris Fritsche, Lars Seidel, William L. Roberts, Hartmut Krause, Fabian Mauss. A comprehensive kinetic model for dimethyl ether and dimethoxymethane oxidation and NO interaction utilizing experimental laminar flame speed measurements at elevated pressure and temperature. Combustion and Flame. 2020, s. 57–74. doi:10.1016/j.combustflame.2020.04.016.
- ↑ MARTIN BERLINER, KATHERINE BELECKI. Synthesis of Alpha-Halo Ethers from Symmetric Acetals and in situ Methoxymethylation of an Alcohol. Org. Synth.. S. 102. Dostupné online.; Coll. Vol.. S. 934.
- ↑ SYNTHESIS OF ALPHA-HALO ETHERS FROM SYMMETRIC ACETALS AND in situ METHOXYMETHYLATION OF AN ALCOHOL [online]. [cit. 2018-09-13]. Dostupné online.