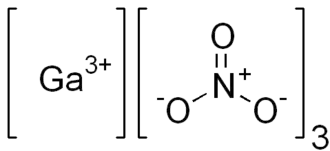
Dusičnan gallitý
| dusičnan gallitý | |
|---|---|
 | |
 Nonahydrát dusičnanu gallitého | |
| Obecné | |
| Systematický název | Dusičnan gallitý |
| Anglický název | Gallium nitrate |
| Německý název | Galliumnitrat |
| Sumární vzorec | Ga(NO3)3 |
| Vzhled | bílá pevná látka |
| Identifikace | |
| Registrační číslo CAS | 13494-90-1 |
| EC-no (EINECS/ELINCS/NLP) | 236-815-5 |
| PubChem | 61635 |
| ChEBI | 231505 |
| UN kód | 1477 |
| SMILES | O=[N+]([O-])[O-].O=[N+]([O-])[O-].O=[N+]([O-])[O-].[Ga+3] |
| InChI | InChI=1S/Ga.3NO3/c;3*2-1(3)4/q+3;3*-1 Key: CHPZKNULDCNCBW-UHFFFAOYSA-N |
| Vlastnosti | |
| Molární hmotnost | 255,7377 g/mol |
| Rozpustnost ve vodě | rozpustný |
| Bezpečnost | |
 GHS03  GHS05  GHS07 Varování[1] | |
| H-věty | H272, H314, H315, H319, H335[1] |
| P-věty | P210, P220, P260, P261, P264, P264+265, P271, P280, P301+330+331, P302+352, P302+361+354, P304+340, P305+351+338, P305+354+338, P316, P319, P321, P332+317, P337+317, P362+364, P363, P370+378, P403+233, P405, P501[1] |
Některá data mohou pocházet z datové položky. | |
Dusičnan gallitý je anorganická sůl gallia a kyseliny dusičné s chemickým vzorcem Ga(NO3)3. Používá se k léčbě symptomatické hyperkalcémie.[2] Účinkuje tak, že brání odbourávání kostí inhibicí aktivity osteoklastů, čímž snižuje množství volného vápníku v krvi. Dusičnan gallitý se také používá k přípravě dalších sloučenin gallia.
Příprava
Dusičnan gallitý je komerčně dostupný jako hydrát. Nonahydrát je také možné připravit rozpuštěním gallia v kyselině dusičné a následnou rekrystalizací.[3]
Vlastnosti
Fyzikální vlastnosti
Dusičnan gallitý a jeho hydráty jsou bílé prášky, které jsou velmi dobře rozpustné ve vodě.[4] Dusičnan gallitý vytváří několik hydrátů: heptahydráty, oktahydráty i nonahydráty. Struktura nonahydrátu dusičnanu gallitého byla zjištěna rentgenovou krystalografií a pomocí galliového MAS NMR.
Chemické vlastnosti
při zahřátí se rozkládá:
- 4 Ga(NO3)3 → 2 Ga2O3 + 12 NO2 + 3 O2
Reaguje se zředěnými zásadami:
- Ga(NO3)3 + 3 NaOH → Ga(OH)3 + 3 NaNO3
známe i příklady podvojné záměny (metateze):
- Ga(NO3)3 + 3 NaF → GaF3 + 3 NaNO3
- Ga(NO3)3 + K3PO4 →GaPO4 + 3 KNO3
- 2 Ga(NO3)3 + 6 Na2S + 3 H2O →2 Ga(OH)3 + 3 H2S + 6 NaNO3
Chemická reaktivita
Dusičnan gallitý může reagovat s redukčními činidly za vzniku tepla a produktů, které mohou být plynné. Produkty samotné mohou vstupovat do dalších reakcí (jako je spalování ve vzduchu). Chemická redukce materiálu v této skupině může být rychlá, ale často vyžaduje iniciaci teplem, katalyzátor a přidání rozpouštědla. Výbušné směsi dusičnanu gallitého s redukčními činidly často přetrvávají nezměněné po dlouhou dobu, pokud je zabráněno iniciaci. Některá anorganická oxidační činidla, jako dusičnan gallitý, jsou soli kovů, které jsou rozpustné ve vodě. Rozpouštědlo se zředí, ale nezruší oxidační schopnost takových materiálů. Obecně mohou anorganická oxidační činidla prudce reagovat s aktivními kovy, kyanidy, estery a thiokyanatany.[1]
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Gallium nitrate na anglické Wikipedii, Galliumnitrat na německé Wikipedii a Нитрат галлия na ruské Wikipedii.
- ↑ a b c d e Gallium nitrate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2025-07-02]. Dostupné online. (anglicky)
- ↑ AUGUST, Chr. Tumoren, tumorähnliche Erkrankungen. [s.l.]: Georg Thieme Verlag 404 s. Dostupné online. ISBN 978-3-13-126181-6. S. 235. (německy)
- ↑ HENDSBEE, Arthur D.; PYE, Cory C.; MASUDA, Jason D. Hexaaquagallium(III) trinitrate trihydrate. Acta Crystallographica Section E Structure Reports Online. 2009-08-15, roč. 65, čís. 8, s. i65–i65. Dostupné online [cit. 2025-07-02]. ISSN 1600-5368. doi:10.1107/S1600536809028086. PMID 21583299.
- ↑ PERRY, Dale L. Handbook of Inorganic Compounds. [s.l.]: CRC Press 584 s. Dostupné online. ISBN 978-1-4398-1462-8. S. 491. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu dusičnan gallitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu dusičnan gallitý na Wikimedia Commons