Dusičnan hlinitý
| dusičnan hlinitý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Dusičnan hlinitý |
| Anglický název | Aluminium nitrate |
| Německý název | Aluminiumnitrat |
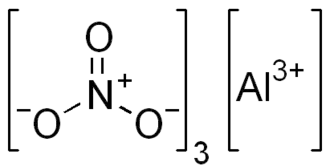
| Funkční vzorec | Al(NO3)3 |
| Sumární vzorec | AlN₃O₉ |
| Identifikace | |
| Registrační číslo CAS | 13473-90-0 7784-27-2 (nonahydrát) |
| EC-no (EINECS/ELINCS/NLP) | 236-751-8 |
| PubChem | 26053 |
| ChEBI | 231496 |
| Vlastnosti | |
| Molární hmotnost | 212,996 g/mol (bezvodý) 375,134 g/mol (nonahydrát) |
| Teplota tání | 66 °C |
| Teplota varu | 150 °C |
| Hustota | 1,72 g/cm3 (nonahydrát) |
| Bezpečnost | |
 GHS03  GHS05  GHS06  GHS07  GHS08 Nebezpečí[1] | |
| H-věty | H272, H315, H319 |
| P-věty | P302+352, P305+351+338 |
| NFPA 704 |  3
0
3
OX
|
Některá data mohou pocházet z datové položky. | |
Dusičnan hlinitý je bílá, ve vodě rozpustná sůl hliníku a kyseliny dusičné.[2] Nejčastěji se vyskytuje ve formě nonahydrátu: Al(NO3)3·9H2O.
Příprava
Dusičnan hlinitý nelze připravit reakcí hliníku s koncentrovanou kyselinou dusičnou. Místo toho se využívá reakce kyseliny dusičné s chloridem hlinitým, vedlejším produktem je chlorid nitrosylu, jež se z roztoku uvolňuje jako plyn. Výhodnější příprava je reakcí kyseliny dusičné s hydroxidem hlinitým.
Dusičnan hlinitý může být také připraven reakcí mezi síranem hlinitým a dusičnanovou solí s vhodným kationtem, jako je baryum, stroncium, vápník, stříbro nebo olovo, např.:
- Al2(SO4)3 + 3 Ba(NO3)2 → 2 Al(NO3)3 + 3 BaSO4
Využití
Dusičnan hlinitý je silné oxidační činidlo. Využívá se v činění kůží, antiperspirantech, inhibitorech koroze, při extrakci uranu, rafinaci ropy a jako nitrační činidlo.[3]
Nonahydrát a další hydratované dusičnany hliníku mají mnoho aplikací.Tyto soli se využívají k výrobě oxidu hlinitého pro přípravu izolačních papírů, v topných prvcích pro katodové trubice a na laminátech jádra transformátoru. Hydratované soli se také používají pro extrakci aktinoidů.[4]
Používá se v laboratořích i výuce jako demonstrace vločkování vody:
- Al(NO3)3 + 3 NaOH → Al(OH)3 + 3 NaNO3
Častěj se ale využívá chlorid a síran hlinitý.
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Aluminium nitrate na anglické Wikipedii a Aluminiumnitrat na německé Wikipedii.
- ↑ a b Aluminium nitrate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ Aluminiumnitrat [online]. Römpp Online: Georg Thieme Verlag [cit. 2025-07-02]. Dostupné online. (německy)
- ↑ gestis.dguv.de [online]. [cit. 2025-07-02]. Dostupné online.
- ↑ PATNAIK, Pradyot. Handbook of Inorganic Chemicals. [s.l.]: McGraw-Hill, 2002. 1086 s. Dostupné online. ISBN 978-0-07-049439-8. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu dusičnan hlinitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu dusičnan hlinitý na Wikimedia Commons