Dusičnan palladnatý
| dusičnan palladnatý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Dusičnan palladnatý |
| Anglický název | Palladium(II) nitrate |
| Německý název | Palladium(II)-nitrat |
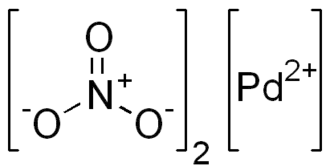
| Sumární vzorec | Pd(NO3)2 |
| Vzhled | hnědá pevná látka (hydrát) |
| Identifikace | |
| Registrační číslo CAS | 10102-05-3 |
| EC-no (EINECS/ELINCS/NLP) | 233-265-8 |
| PubChem | 24932 |
| SMILES | [Pd+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| Vlastnosti | |
| Molární hmotnost | 230,43 g/mol |
| Rozpustnost ve vodě | rozpustný |
| Bezpečnost | |
 GHS03  GHS05  GHS07  GHS09 Nebezpečí[1] | |
| H-věty | H271, H272, H290, H302, H314, H318, H400, H410[1] |
| P-věty | P210, P220, P234, P260, P264, P264+265, P270, P273, P280, P283, P301+317, P301+330+331, P302+361+354, P304+340, P305+354+338, P306+360, P316, P317, P321, P330, P363, P370+378, P371+380+375, P390, P391, P405, P406, P420, P501[1] |
Některá data mohou pocházet z datové položky. | |
Dusičnan palladnatý je anorganická sloučenina se vzorcem Pd(NO3)2. Jedná se o červenohnědou pevnou látku. Jako roztok v kyselině dusičné katalyzuje přeměnu alkenů na dinitrátové estery.[2]
Příprava
Dusičnan palladnatý se získává rozpuštěním palladia v horké koncentrované kyselině dusičné:[3]
- 3 Pd + 8 HNO3 → 3 Pd(NO3)2 + 2 NO + 4 H2O
Vlastnosti
Fyzikální vlastnosti
Při pokojové teplotě je dusičnan palladnatý červenohnědý prášek.[3] Je mírně rozpustný ve vodě a díky hydrolýze tvoří zakalený roztok. Je rozpustný ve zředěné kyselině dusičné.
Chemické vlastnosti
Dusičnan palladnatý se při zahřívání rozkládá.
- 2 Pd(NO3)2 → 2 PdO + 4 NO2 + O2
Ve vodných roztocích prochází úplnou hydrolýzou a vytváří hnědou zásaditou sůl:
- Pd(NO3)2 + H2O → Pd(NO3)OH + HNO3
- Pd(NO3)2 + 2 H2O → Pd(OH)2 + 2 HNO3
Reaguje s koncentrovanou kyselinou chlorovodíkovou:
- Pd(NO3)2 + 4 HCl → H2[PdCl4] + 2 HNO3
Reaguje se zásadami:
- Pd(NO3)2 + 2 NaOH → Pd(OH)2 + 2 NaNO3
Má silné oxidační účinky, protože ionty Pd2+ i dusičnanové ionty NO -
3 patří mezi oxidační činidla. Srážením roztoku hydroxidu sodného se získá krystalický oxid palladnatý.[4]
Využití
Dusičnan palladnatý je vhodný pro výrobu čistého síranu palladnatého.[5]
Odkazy
Reference
V tomto článku byly použity překlady textů z článků Palladium(II)-nitrat na německé Wikipedii, Palladium(II) nitrate na anglické Wikipedii a Нитрат палладия(II) na ruské Wikipedii.
- ↑ a b c d Palladium nitrate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2025-07-01]. Dostupné online. (anglicky)
- ↑ WENZEL, Timothy T. Palladium(II) Nitrate. Příprava vydání John Wiley & Sons, Ltd. Chichester, UK: John Wiley & Sons, Ltd Dostupné online. ISBN 978-0-471-93623-7, ISBN 978-0-470-84289-8. doi:10.1002/047084289x.rp013. (anglicky)
- ↑ a b SIMON, Cotton. The Chemistry of Precious Metals. Rutland: Blackie Academic and Professional, 1997. Dostupné online. ISBN 0-7514-0413-6. S. 188. (anglicky)
- ↑ SCHREYER, Martin. Beiträge zur Chemie der Übergangsmetalloxide. 2002 [cit. 2025-07-01]. Thesis. Universitäts- und Landesbibliothek Bonn. Dostupné online.
- ↑ BRAUER, Georg. Handbuch der präparativen anorganischen Chemie. [s.l.]: Enke 732 s. Dostupné online. ISBN 978-3-432-87823-2. S. 1731. (německy)
Externí odkazy
 Obrázky, zvuky či videa k tématu dusičnan palladnatý na Wikimedia Commons
Obrázky, zvuky či videa k tématu dusičnan palladnatý na Wikimedia Commons