Fluorid perchlorylu
| Fluorid perchlorylu | |
|---|---|
 Strukturní vzorec | |
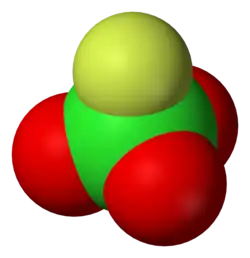 Model molekuly | |
| Obecné | |
| Systematický název | fluorid perchlorylu |
| Ostatní názvy | trioxyfluorid chloristý |
| Sumární vzorec | ClO3F |
| Vzhled | bezbarvý plyn[1] |
| Identifikace | |
| Registrační číslo CAS | 7616-94-6 |
| EC-no (EINECS/ELINCS/NLP) | 231-526-0 |
| PubChem | 24258 |
| SMILES | O=Cl(=O)(=O)F |
| InChI | InChI=1S/ClFO3/c2-1(3,4)5 |
| Vlastnosti | |
| Molární hmotnost | 102,45 g/mol |
| Teplota tání | −146 °C (127 K)[1] |
| Teplota varu | −46,7 °C (226,4 K)[1] |
| Rozpustnost ve vodě | 0,06 g/100 ml (20 °C)[1] |
| Tlak páry | 1,05 MPa (20 °C) 1,19 MPa (25 °C)[1] |
| Ionizační energie | 13,60 eV[1] |
| Bezpečnost | |
 GHS03  GHS05  GHS06 | |
| H-věty | H270 H314 H318 H330[1] |
| P-věty | P220 P244 P260 P264+265 P271 P280 P284 P301+330+331 P302+361+354 P304+340 P305+354+338 P316 P317 P320 P321 P363 P370+376 P403+233 P405 P501[1] |
Některá data mohou pocházet z datové položky. | |
Fluorid perchlorylu je plynná chemická sloučenina se vzorcem ClO3F, acylfluorid kyseliny chloristé. Jedná se o silné oxidační a fluorační činidlo.[1]
I přes malou slučovací entalpii (ΔfH° = −22 kJ/mol) je kineticky stálý a rozkládá se až při 400 °C.[2] Snadno reaguje s anionty a redukčními činidly, kde atom chloru slouží jako elektrofil.[2]
S některými redukčními činidly, například amidy nebo hydridy kovů, reaguje výbušně.[3]
Oproti fluoridu chlorylu se ve vodě rozkládá výrazně pomaleji.
Příprava a vlastnosti
Fluorid perchlorylu se získává převážně fluoracemi chloristanů. Původní příprava využívala plynný fluor, případně fluoridy a anodovou oxidaci, při tom ale vznikaly výbušné směsi plynů.[4] Tento postup byl nahrazen jiným, využívajícím fluorid antimoničný:[2]
ClO -
4 + 3 HF + 2 SbF5 → ClO3F + H3O+ + 2 SbF -
6
Další možností je reakce chloristanu draselného s přebytkem kyseliny fluorosírové za vzniku hydrogensíranu draselného a fluoridu perchlorylu:[4]
KClO4 + HSO3F → KHSO4 + FClO3
ClO3F reaguje s alkoholy, přičemž se vytváří alkylované chloristany, fungující jako výbušniny s vysokou citlivostí na náraz.[5] Za přítomnosti Lewisových kyselin lze jeho prostřednictvím navazovat skupiny -ClO3 na aromatické kruhy elektrofilními aromatickými substitucemi.[6]
Použití
Fluorid perchlorylu se používá v organické chemii jako fluorační činidlo;[2] jedná se o první průmyslově využité elektrofilní fluorační činidlo, používané od 60. let 20. století k tvorbě fluorovaných steroidů.[5]
Za přítomnosti chloridu hlinitého může být tato látka použita k elektrofilním perchlorylacím aromatických sloučenin.[7]
Fluorid perchlorylu byl zkoumán jako možné oxidační činidlo pro kapalná raketová paliva.[8] Oproti fluoridu chlorečnému a bromičnému má mnohem nižší specifický impuls, ale nezpůsobuje korozi nádrží; navíc nevyžaduje skladování za nízkých teplot. Fluorid perchlorylu je plně mísitelný se všemi Interhalogenovými oxidačními činidly, jako jsou fluorid chloritý a fluorid chlorečný, a příslušné směsi mohou poskytovat kyslík potřebný ke správnému spalování uhlíkových paliv.[9]
Lze jej také použít jako zdroj excitací při plamenové fotometrii.[10]
Bezpečnost
Fluorid perchlorylu dráždí plíce a oči a na kůži způsobuje popáleniny.[11]
K příznakům vystavení této látce patří nevolnost, bolesti hlavy, synkopy, a cyanóza. Větší množství způsobují zánět dýchací soustavy a otok plic.[8]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Perchloryl fluoride na anglické Wikipedii.
- ↑ a b c d e f g h i j https://pubchem.ncbi.nlm.nih.gov/compound/24258
- ↑ a b c d Harry Julius Emeléus; A. G. Sharpe. Advances in inorganic chemistry and radiochemistry, Volume 18. [s.l.]: [s.n.], 1976. ISBN 0-12-023618-4.
- ↑ Jared Ledgard. The Preparatory Manual of Explosives. [s.l.]: [s.n.], 2007. ISBN 978-0-615-14290-6. S. 77.
- ↑ a b Clark 2018, s. 80.
- ↑ a b Peer Kirsch. Modern fluoroorganic chemistry: synthesis, reactivity, applications. [s.l.]: Wiley-VCH, 2004. ISBN 3-527-30691-9. S. 74.
- ↑ Peter Bernard David De la Mare. Electrophilic halogenation: reaction pathways involving attack by electrophilic halogens on unsaturated compounds. [s.l.]: [s.n.], 1976. ISBN 0-521-29014-7. S. 63.
- ↑ C. E. Inman; R. E. Oesterling; E. A. Tyczkowski. Reactions of Perchloryl Fluoride with Organic Compounds. I. Perchlorylation of Aromatic Compounds. Journal of the American Chemical Society. 1958, s. 5286–5288. ISSN 0002-7863. doi:10.1021/ja01552a069.
- ↑ a b John Burke Sullivan; Gary R. Krieger. Clinical environmental health and toxic exposures. [s.l.]: Lippincott Williams & Wilkins, 2001. ISBN 0-683-08027-X. S. 969.
- ↑ John Drury Clark. Ignition!: An Informal History of Liquid Rocket Propellants. [s.l.]: Rutgers University Press, 2018-05-23. ISBN 978-0-8135-9918-2. S. 302.
- ↑ G. E. Schmauch; E. J. Serfass. The Use of Perchloryl Fluoride in Flame Photometry. Applied Spectroscopy. S. 98–102. doi:10.1366/000370258774615483. Bibcode 1958ApSpe..12...98S.
- ↑ Documentation for Immediately Dangerous To Life or Health Concentrations [online]. Centers for Disease Control and Prevention [cit. 2013-10-31]. Dostupné online.
Související články
- Fluorid perjodylu
- Fluorid perbromylu