Iontově selektivní elektroda
Iontově selektivní elektroda (též iontově specifická elektroda) je jednomembránová elektroda sloužící k měření koncentrace jednoho daného iontu v roztoku;[1] převádí změnu koncentrace iontu na elektrický potenciál. Potenciál (teoreticky) závisí na logaritmu aktivity daného iontu, podle Nernstovy rovnice. Iontově selektivní elektrody mají využití v mnoha oblastech, například biologii, chemii, a zemědělství.[2]
Teorie
Při měřeních pomocí iontově selektivních elektrod se porovnává signál analytu a elektrochemický potenciál elektrody; tyto elektrody mohou být různých druhů. Iontově selektivní membrána (tvořená sklem, krystalickou látkou, kapalinou, nebo polymerem) umožňuje selektivní průchod některých iontů.[1]
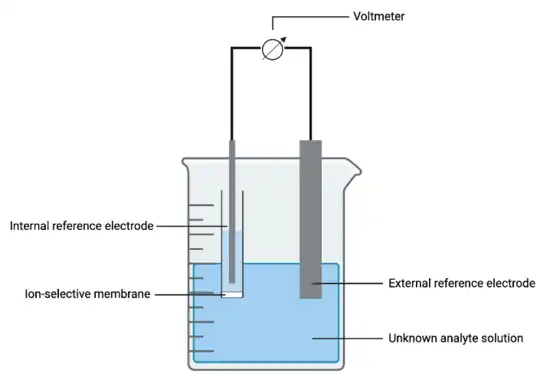
Při analýze iontově selektivní elektrodou se potenciál vnitřní referenční elektrody porovnává s potenciálem elektrody v roztoku stanovovaného analytu o známé koncentraci; součástí soustavy vystavené roztoku je také vnější referenční elektroda. Potenciál se určuje pomocí tohoto vzorce:
, kde Eise zahrnuje potenciál vnitřní referenční elektrody a iontově selektivní membrány, Em. Hodnota Eise je ovlivňována koncentrací analytu ve vnitřním roztoku a Em aktivitou analytu na stranách selektivní membrány. Potenciál vnější referenční elektrody, Eref, je vytvářen poloreakcí na elektrodě.
Referenční elektrody
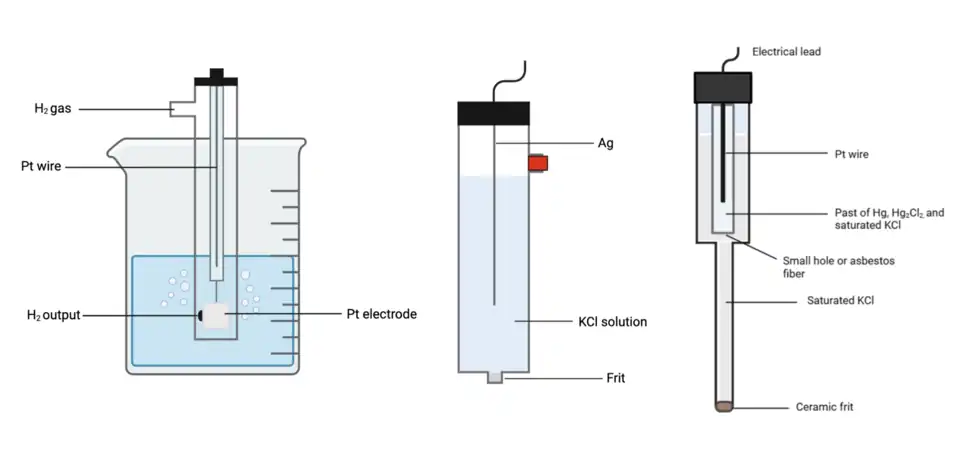
Jako referenční elektrody se nejčastěji používají standardní vodíková elektroda, nasycená kalomelová elektroda, a Ag/AgCl elektroda.[3]
Standardní vodíková elektroda je primární referenční elektroda, která má za tlaku 100 kPa a všech teplot potenciál 0 voltů. Na obrázku vlevo je zobrazena elektroda v podobě platinového drátu, která není součástí reakce (působí jako katalyzátor) a lze ji použít jako katodu i jako anodu. Drát je ponořen do kyselého roztoku s přívodem plynného vodíku. Na povrchu platinové elektrody probíhá tato poloreakce:
Pro běžné použití je vodíková elektroda nevhodná a nahrazuje se tak kalomelovou. Platinový drát je umístěn v pastovité směsi Hg a Hg2Cl2 a ponořen do nasyceného roztoku KCl. Vespod referenční elektrody je umístěna keramická zátka, sloužící jako solný můstek. Souhrnná rovnice poloreakce je:
Vzhledem k toxicitě rtuti se častěji než kalomelová elektroda používá AgCl. Drát z Ag/AgCl je ponořen do roztoku KCl a na spodní straně elektrody se nachází keramická zátka, sloužící jako solný můstek. Rovnice poloreakce je:
Druhy iontově selektivních membrán
Používány jsou čtyři základní druhy iontově selektivních membrán: skleněná, pevná, kapalná, a složená.[4][5]
Skleněné membrány
Skleněné membrány se vyrábějí z iontoměničových skel. Silikátové elektrody mívají dobrou selektivitu pouze vůči některým jednonásobně nabitým kationtům, převážně H+, Na+, a Ag+; chalkogenidová skla i vůči dvojnásobně nabitým, například Pb2+ a Cd2+. Skleněné membrány vykazují vysokou chemickou odolnost a lze je použít i ve značně agresivních prostředích. Tento druh elektrody se používá například při měření pH.
Krystalické membrány
Krystalické membrány jsou tvořeny mono- nebo polykrystaly jedné látky. Mají dobré selektivity, protože jejich potenciály ovlivňují pouze ionty schopné se zapojit do jejich krystalové mřížky. Mohou být selektivní vůči kationtům i aniontům látky tvořící membránu. Příkladem může být fluoridová selektivní elektroda, obsahující krystaly fluoridu lanthanitého.
Iontoměničové membrány
Iontoměničové membrány jsou tvořeny organickými polymery obsahujícími iontoměničové pryskyřice. Jedná se o nejčastější druh iontově selektivní elektrody. Výběrem pryskyřic lze vytvořit selektivní elektrody pro desítky různých jedno- i víceatomových kationtů i aniontů. Mívají nízkou chemickou i fyzikální odolnost a krátkou životnost. Jako příklad lze uvést draslíkovou selektivní elektrodu, využívající jako iontoměnič valinomycin.
Enzymové elektrody
Enzymové elektrody nejsou pravými iontově-selektivními elektrodami. Tyto elektrody mívají „dvojitý reakční mechanismus“ - enzym reaguje s danou látkou a produkt reakce (obvykle H+ nebo OH−) se detekuje skutečnou iontově selektivní, například pH, elektrodou. Tyto reakce probíhají v membránách pokrývajících skutečné iontově selektivní elektrody.
Příkladem mohou být elektrody citlivé na glukózu.
Výroba
Iontově selektivní elektrody obsahují skleněné trubice o průměru kolem 2 millimetrů. Polyvinylchlorid se rozpustí ve vhodném rozpouštědle a přidají se plastifikátory (obvykle ftaláty), podobně jako při výrobě jiných výrobků z vinylových plastů. Dostatečné iontové specifity se dosáhne přidáním vhodného iontového kanálu k roztoku, což umožní průchod daných iontů přes polymer a omezí průchody jiných iontů a vody.
Jeden konec trubice se ponoří do vytvořeného roztoku, po odstranění dojde ke ztuhnutí polymeru, jenž na jednom konci vytvoří zátku. Z opačného konce se trubice naplní roztokem, poté ji lze přechovávat v solném roztoku. Otevřený konec se mírně rozšíří a vloží se stříbrný nebo platinový drát.
Použití
Drát elektrody je napojen na jeden výstup galvanometru, na druhý výstup je napojena referenční elektroda, a obě elektrody jsou ponořeny do zkoumaného roztoku. Průchodem iontů vzniká elektrické napětí, měřené galvanometrem; na základě kalibrací vůči standardním roztokům o různých koncentracích lze zjistit koncentraci iontů ve zkoumaném roztoku.
Mohou se objevit úniky roztoků mezi vinylovou zátkou a trubicí, což umožňuje průchod jakýchkoliv iontů, kdy se zmenšují rozdíly mezi signály pro různé kalibrační roztoky, v takovém případě je daná elektroda nepoužitelná. Iontové kanály v zátce mohou být blokovány nebo jinak deaktivovány, což vede ke ztrátě citlivosti elektrody. Odpověď elektrody a galvanometeru závisí na teplotě a také se s časem posunuje, takže je potřebná opětovná kalibrace elektrody, ideálně alespoň jedním kalibračním vzorkem před a jedním po každém zkoumaném vzorku. Po ponoření do roztoku trvá přizpůsobení elektrody a galvanometru novému roztoku někdy i více než 5 minut a je tak třeba najít vhodný okamžik, kdy se odpověď ustálí, ale nedojde k přílišnému posunu.
Rušivé vlivy
Nejvýznamnějším vlivem omezujícím použití iontově selektivních elektrod jsou rušení vyvolávaná jinými než měřenými ionty. Iontově selektivní elektrody nejsou zcela iontově specifické; bývají také citlivé na jiné ionty s podobnými fyzikálními vlastnostmi. Většinu těchto vlivů lze zanedbat, v některých případech ale může být elektroda mnohem citlivější na nežádoucí ion než na zkoumaný, ten tak smí být přítomen pouze ve velmi nízké koncentraci, případně zcela nepřítomný. Relativní citlivosti jednotlivých druhů iontově selektivních elektrod na různé rušivé ionty jsou dobře popsány; přesná míra rušení ale závisí také na dalších jevech, údaje tak nelze opravit úplně přesně. Výpočet relativního narušení podle koncentrací rušivých iontů lze použít pouze jako odhad, zda dojde k významnému narušení, nebo jestli je třeba jejich vliv omezit úpravou postupu.
Dusičnanové elektrody jsou ovlivňovány chloristany, jodidy, chloridy, a sírany, jednotlivé ionty se výrazně liší mírou narušování: vliv chloristanů je přibližně 50 000krát silnější než u stejného množství dusičnanů, sírany v 1000násobném množství oproti dusičnanům vytváří odchylku stanovení okolo 10 %.[6] Chloridy způsobí 10% odchylku při koncentraci přibližně 30krát převyšující koncentraci dusičnanů, ale lze je odstranit přidáním síranu stříbrného.
Dusičnany lze stanovovat také pomocí elektrod citlivých na plynný amoniak, což dovoluje stanovení amonných kationtů a následně i dusičnanů; tento postup využívá redukční vlastnosti chloridu titanitého, který redukuje dusičnany na amonné kationty. Při pH 12-13 se veškeré amonné ionty ve vzorku přemění na plynný amoniak, který je poté detekován elektrodou.[7]
Iontově selektivní elektrody pro alkalické kovy
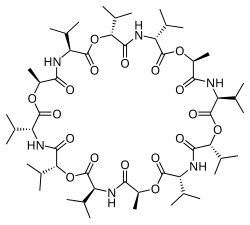
Elektrody specifické pro ionty alkalických kovů (Li+, Na+, K+, Rb+, Cs+) zachycují ionty alkalických kovů v molekulových dutinách s velikostmi odpovídajícími velikostem příslušných iontů; například ke stanovování draselných iontů se používají elektrody založené na valinomycinu.[8]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Ion-selective electrode na anglické Wikipedii.
- ↑ a b Herbert E. Spiegel; W. N. Opdycke. Ion-Selective Electrodes. Advances in Clinical Chemistry. 1986, s. 1–47. Dostupné online.
- ↑ A. J. Bard; L. Faulkner. Electrochemical Methods: Fundamentals and Applications. New York: Wiley, 2000. ISBN 978-0-471-04372-0.
- ↑ Ion-Selective Electrodes. [s.l.]: [s.n.] Dostupné online. doi:10.1007/978-3-642-36886-8.pdf.
- ↑ R. P. Buck; E. Lindner. Recommendations for nomenclature of ion-selective electrodes. Pure and Applied Chemistry. 1994, s. 2527–2536. Dostupné online. doi:10.1351/pac199466122527.
- ↑ Eric Bakker; Yu Qin. Electrochemical sensors. Analytical Chemistry. 2006, s. 3965–3984. doi:10.1021/ac060637m. PMID 16771535.
- ↑ Nitrate Electrode Instruction Manual, ThermoFisher Scientific, Beverly, MA 01915
- ↑ D. W. Rich, B. Grigg, G. H. Snyder, (2006) "Determining ammonium and nitrate using a gas sensing ammonia electrode" Soil and Crop Science Society of Florida: 1-4
- ↑ Peter C. Hauser. The Alkali Metal Ions: Their Role in Life. [s.l.]: Springer, 2016. ISBN 978-3-319-21755-0. doi:10.1007/978-3-319-21756-7_2. PMID 26860298. Kapitola 2. Determination of Alkali Ions in Biological and Environmental Samples, s. 11–25.
Související články
- Fluoridová selektivní elektroda
- Iontové transportní číslo
- Solvatovaný elektron