Komplexy trimethylenmethanu
Komplexy trimethylenmethanu jsou komplexní sloučeniny, ve kterých jako ligand slouží trimethylenmethan. Některé z těchto komplexů mohou být využity v organické syntéze.[1]
Historie
Příprava trikarbonylu cyklobutadienželeza ukázala, že lze vytvořit komplexy organických ligandů, které nejsou izolovatelné ve volné podobě. Trimethylenmethan (TMM) je vlastnostmi podobný cyklobutadienu, čehož v roce 1966 bylo využito k první popsané přípravě komplexu přechodného kovu a trimethylenmethanu, (CO)3FeC(CH2)3, který se stal výchozím bodem pro další výzkum.
Příprava
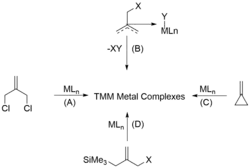
Trimethylenmethanové komplexy je možné připravit čtyřmi různými způsoby: (A) dehalogenacemi α,α'-dihalogenovaných prekurzorů, (B) tepelně spouštěným odštěpováním XY (XY = HCl, Br2, nebo CH4) z η3-methylallylových komplexů, (C) otevíráním kruhů alkylidencyklopropanů, a (D) eliminacemi Me3SiX [X = OAc, Cl, OS(O)2Me] z funkcionalizovaných allylsilanů.
Dehalogenace α,α'-dihalogenovaných sloučenin
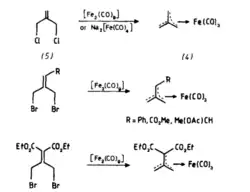
η4-[C(CH2)3]Fe(CO)3, první popsaný komplex trimethylenmethanu, lze připravit reakcí 3-chlor-2-chlormethylprop-1-enu s nonakarbonylem diželeza (Fe2(CO)9) nebo Na2[Fe(CO)4].[2]
Podobnými způsoby byla připravena řada dalších komplexů železa se substituovanými trimethylenmethany.[3][4][5]
Další možností je tepelná příprava z η3-methylallylových komplexů; příkladem může být rozklad allylového komplexu železa, získaného z 3-chlor-2-methylprop-1-enu a [Fe2(CO)9].[3]
Otevírání kruhů alkylidencyklopropanů
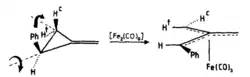
Za přítomnosti [Fe2(CO)9] se 2-substitované methylencyklopropany mění na η4-trimethylenmethanové komplexy s různými funkčními skupinami, například (R1 = H, R2 = Ph), (R1 = Me, R2 = Ph), (R1 = R2 = Ph), a (R1 = H, R2 = CH=CH2).[7]
Eliminace Me3SiX [X = OAc, Cl, OS(O)2Me] z funkcionalizovaných allylsilanů
Na přípravu η3-trimethylenmethanových komplexů lze použít tetrakis(trifenylfosfin)palladium.[1] Allylsilany se oxidačně adují na některé komplexy d8 za tvorby η1-allylových komplexů, ze kterých se následně vytvářejí η3-allylové komplexy, a nakonec vznikají oddělením Me3SiX komplexy typu η4-trimethylenmethan. Navržený mechanismus byl potvrzen izolací meziproduktu.[8]
Struktura
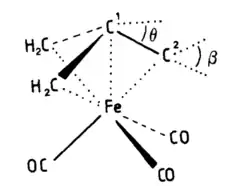
Komplex η4-C(CH2)3]Fe(CO)3 má ligandy, karbonyl a trigonálně pyramidální trimethylenmethan, uspořádané v deštníkovité konfiguraci. Centrální atom uhlíku v trimethylenmethanu se oproti ostatním nachází blíže k železnému centru (194(1) pm oproti 212 pm);[9] tyto údaje byly potvrzeny rentgenovou difrakcí a vibračním spektrem.[10]
Vypočtená hodnota potenciální energie rovinného trimethylenmethanového ligandu činí 87 kJ mol−1;[11] u „stažené“ konformace, odpovídající experimentální geometrii, jde o 98,6 kJ mol. U této konformace se orbitaly s mísí s orbitaly e", což způsobuje výraznější orientaci směrem ke kovovému centru. V důsledku tohoto spojení je překryv orbitalů e" a 2e větší.[12]
Reakce
Trimethylenmethanové komplexy mohou vstoupit do mnoha různých reakcí s elektrofily či nukleofily i do redoxních reakcí.
η4-C(CH2)3]Fe(CO)3 vytváří reakcí s chlorovodíkem η3-CH3C(CH2)]Fe(CO)3. Komplexy železa se substituovanými trimethylenmethany oproti tomu se silnými kyselinami tvoří konjugované dienyl-Fe kationty a η4-dienové komplexy.[13]
η4-C(CH2)3]Mo(CO)2C5H +
5 na sebe navazuje nukleofily, čímž vznikají neutrální η3-allylové komplexy.[14]
[Fe{η4-C(CH2)3(L)3] (L = PMe nebo PMe2Ph) reaguje s trifluormethansulfonátem stříbrným za vzniku 17elektronového kationtu.[5]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Trimethylenemethane complexes na anglické Wikipedii.
- ↑ a b Barry M. Trost; Guillaume Mata. Forging Odd-Membered Rings: Palladium-Catalyzed Asymmetric Cycloadditions of Trimethylenemethane. Accounts of Chemical Research. 2020, s. 1293–1305. doi:10.1021/acs.accounts.0c00152. PMID 32525684.
- ↑ G. F. Emerson; K. Ehrlich; W. P. Giering; P. C. Lauterbur. Trimethylenemethaneiron Tricarbonyl. Journal of the American Chemical Society. 1966, s. 3172–3173. Dostupné online. ISSN 0002-7863. doi:10.1021/acs.accounts.0c00152. PMID 10.1021/ja00965a077.
- ↑ a b Kenneth Ehrlich; George F. Emerson. Trimethylenemethane iron tricarbonyl complexes. Journal of the American Chemical Society. 1972, s. 2464–2470. Dostupné online. ISSN 0002-7863. doi:10.1021/ja00762a045.
- ↑ Benedict R. Bonazza; C. Peter Lillya; Elaine S. Magyar; Gary Scholes. (Cross-conjugated dienyl)tricarbonyliron cations. 2. 4-Methyl derivatives. Journal of the American Chemical Society. 1979, s. 4100–4106. Dostupné online. ISSN 0002-7863. doi:10.1021/ja00509a016.
- ↑ a b Jean Michel Grosselin; Hubert Le Bozec; Claude Moinet; Loic Toupet; Pierre H. Dixneuf. Electron-rich, hydrocarbon-metal complexes: synthesis and reversible one-electron oxidation. X-ray structure of a 17-electron iron cation. Journal of the American Chemical Society. 1985, s. 2809–2811. Dostupné online. ISSN 0002-7863. doi:10.1021/ja00295a045.
- ↑ Allan R. Pinhas; Barry K. Carpenter. Frontier molecular orbital control of stereochemistry in organometallic electrocyclic reactions. Journal of the Chemical Society, Chemical Communications. 1980, s. 15–17. Dostupné online. ISSN 0022-4936. doi:10.1039/C39800000015.
- ↑ R. Noyori; T. Nishimura; H. Takaya. Reaction of methylenecyclopropanes with enneacarbonyldi-iron: a new route tricarbonyltrimethylenemethaneiron complexes. Journal of the Chemical Society D: Chemical Communications. 1969, s. 89. Dostupné online. ISSN 0577-6171. doi:10.1039/C29690000089.
- ↑ Michael D. Jones; Raymond D. W. Kemmitt; Andrew W. G. Platt. Trimethylenemethane metal complexes. Part 1. Synthesis of ruthenium, osmium, rhodium, and iridium complexes. Journal of the Chemical Society, Dalton Transactions. 1986, s. 1411–1418. Dostupné online. ISSN 1364-5447. doi:10.1039/DT9860001411.
- ↑ Masoumeh Mousavi; Gernot Frenking. Bonding analysis of trimethylenemethane (TMM) complexes [(CO)3M–TMM] (M = Fe, Ru, Os, Rh+). Absence of expected bond paths. Journal of Organometallic Chemistry. 2013-12-15, s. 2–7. Dostupné online. ISSN 0022-328X. doi:10.1016/j.jorganchem.2013.03.047.
- ↑ Melvyn R. Churchill; Karen Gold. The molecular configuration of (phenyltrimethylenemethane)tricarbonyliron. Chemical Communications. 1968, s. 693–694. Dostupné online. ISSN 0009-241X. doi:10.1039/C19680000693.
- ↑ Thomas A. Albright; Peter Hofmann; Roald Hoffmann. Conformational preferences and rotational barriers in polyene-ML3 transition metal complexes. Journal of the American Chemical Society. 1977, s. 7546–7557. Dostupné online. ISSN 0002-7863. doi:10.1021/ja00465a025.
- ↑ Norihiko Yasuda; Yasushi Kai; Noritake Yasuoka; Nobutami Kasai; Masao Kakudo. X-Ray molecular structure of allene-trimer complexes of hexacarbonyldi-iron. Journal of the Chemical Society, Chemical Communications. 1972, s. 157–158. Dostupné online. ISSN 0022-4936. doi:10.1039/C39720000157.
- ↑ Keith A. Horn; Robert B. Grossman; Anne A. Whitenack. The palladium catalyzed synthesis of substituted phenylethynylpentamethyldisilanes and phenylethynylheptamethyltrisilanes. Journal of Organometallic Chemistry. 1987, s. 271–278. Dostupné online. ISSN 0022-328X. doi:10.1016/0022-328X(87)85094-5.
- ↑ Stephen R. Allen, Stephen G. Barnes, Michael Green, Grainne Moran, Lynda Trollope, Nicholas W. Murrall, Alan J. Welch, Dima M. Sharaiha. Reactions of co-ordinated ligands. Part 30. The transformation of methylenecyclopropanes into cationic η4-trimethylenemethanemolybdenum complexes, reactions with nucleophilic reagents, and the molecular structure of [Mo{η4-C(CH2)3}(CO)2(η-C5Me5)][BF4]. Journal of the Chemical Society, Dalton Transactions. 1984, s. 1157–1169. Dostupné online. ISSN 1364-5447. doi:10.1039/DT9840001157.