Kyselina polyasparagová
Kyselina polyasparagová je biologicky rozložitelný a ve vodě rozpustný kondenzační polymer založený na kyselině asparagové.[1][2] Využít se dá například při změkčování vody.[3] Chemickým překřížením lze z této látky vytvořit hydrogely,[4] které jsou citlivé na pH a v kyselých prostředích se smrskávají, zatímco v zásaditých bobtnají.[4]
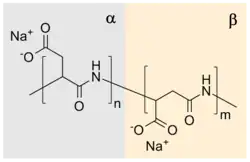
Sodnou solí této kyseliny je polyaspartát sodný.
V přírodě se kyselina polyasparagová vyskytuje jako součást bílkovin, kde vytváří řetězce až 50 aminokyselin,[5] ale nebyla z žádného přírodního zdroje izolována jako čistý homopolymer.[6]
První izolaci syntetického polyaspartátu sodného, získaného tepelnou kondenzací kyseliny asparagové, popsal Hugo Schiff koncem 19. století;[7] později navrhl, že meziproduktem této polykondenzace by mohl být polysukcinimid.[8][9]
Kyselinu polyasparagovou lze získat jak jako samotnou kyselinu, tak i jako sodnou sůl.[2]
Vlastnosti a struktura
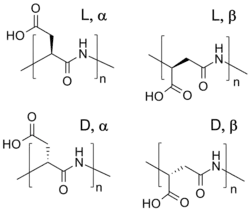
Vzhledem k přítomnosti karboxylových skupin je kyselina polyasparagová aniontovým polyelektrolytem. Přírodní vzorky obsahují α,-propojené molekuly kyseliny L-asparagové;[5] oproti tomu mohou opakující se jednotky syntetického produktu, v závislosti na stereoizomerii výchozí suroviny (zda jde o kyselinu D- nebo L-asparagovou) a syntetickém postupu, obsahovat čtyři různé izomery. Vzhledem k přítomnosti amidových vazeb je kyselina polyasparagová biologicky rozložitelná.[2]
Výroba

Kyselinu polyasparagovou lze získat několika způsoby; nejjednodušší[10] a nejstarší postup[6] spočívá v zahřívání kyseliny asparagové za účelem dehydratace, po níž vzniklý polysukcinimid reaguje s vodným roztokem hydroxidu sodného, což vede k částečnému otevírání sukcinimidových kruhů. V tomto kroku se tvoří DL-(α,β)-poly(aspartát) sodný obsahující 30 % α vazeb a 70 % β vazeb[11] náhodně rozdělených v polymerním řetězci[12] a racemizované aspartátové chirální centrum.[13] K vylepšení tepelné polymerizace bylo vyvinuto několik katalyzátorů. Jejich výhodami jsou urychlení reakce a vyšší molekulové hmotnosti produktů.[14][15]
Další možností výroby kyseliny polyasparagové je polymerizace maleinanhydridu za přítomnosti roztoku hydroxidu amonného.[2][16]
Polymerizace derivátů N-karboxyanhydridu umožňují řídit uspořádání monomerů[17] polymerizacemi esterů kyseliny asparagové[18] nebo využitím enzymů.[19]
Těmito způsoby je možné získat čisté homopolymery, D- nebo L-polyaspartát obsahující pouze α- nebo β-spojení.
Tvorba kyseliny polyasparagové je příkladem postupné polymerizace za vzniku polyamidu. Kyselina asparagová se může polymerizovat při 180 °C za současné dehydratace a vzniku poly(sukcinimidu). Vzniklý polymer reaguje s hydroxidem sodným za hydrolýzy jedné ze dvou amidových vazeb sukcinimidového kruhu a vytvoří sodný karboxylát; zbývající amidová vazba tak propojí aspartátové zbytky. Tyto aspartátové zbytky se označují α nebo β podle toho, jaký karbonyl je součástí polymerního řetězce. U α formy se nachází polymerní řetězec o jeden uhlík vedle karbonylu, zatímco v případě β formy je vzdálen o dva uhlíky. Uvedenou reakcí vzniká poly(aspartát) sodný obsahující přibližně 30 % spojení α a 70 % spojení β-.[2]
.svg.png)
Použití
Kyselina polyasparagová jsou biologicky rozložitelnými alternativami polyaniontových materiálů, jako je kyselina polyakrylová.[20] Mohou bránit ukládání uhličitanu vápenatého, síranu vápenatého, síranu barnatého a fosforečnanu vápenatého a být použity při odsolování vody a zpracovávání odpadních vod.[21]
Chelatační vlastnosti této látky lze využít k ochraně před korozí.[22] Ta také může sloužit jako detergent a dispergační látka.[23]
Polyaspartát má rovněž využití v biomedicíně. Jeho vysokou afinitu k vápníku lze uplatnit v cíleném doručování léčiv do kostí.[2] Hlavní složkou kostí (kolem 70 %) je hydroxyapatit (mineralizovaný fosforečnan vápenatý). Upravený polyaspartát lze použít i v jiných oblastech biomedicíny.[2]
Protože se dá vyrobit způsobem šetrným k životnímu prostředí a navíc se vyznačuje biologickou rozložitelností, tak může být kyselina polyasparagová náhradou některých materiálů, například polyakrylátu sodného, při výrobě plenek a v zemědělství.[24][25][26] Polyaspartát může sloužit jako nasákavý materiál na obaly od potravin.[27] Míra nasákavosti, související s mechanickými vlastnostmi hydrogelu, může být upravována změnami hustoty překřížení ve struktuře.[4]
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Polyaspartic acid na anglické Wikipedii.
- ↑ KLEIN, Thomas; MORITZ, Ralf-Johann; GRAUPNER, René. Polyaspartates and Polysuccinimide. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. doi:10.1002/14356007.l21_l01. S. l21_l01. (anglicky) DOI: 10.1002/14356007.l21_l01.
- ↑ a b c d e f g Adelnia Hossein; Huong D. N. Tran; Peter J. Little; Idriss Blakey; Hang T. Ta. Poly(aspartic acid) in Biomedical Applications: From Polymerization, Modification, Properties, Degradation, and Biocompatibility to Applications. ACS Biomaterials Science & Engineering. 2021-06-14, s. 2083–2015. Dostupné online. doi:10.1021/acsbiomaterials.1c00150. PMID 33797239.
- ↑ Michael Schwamborn. Chemical synthesis of polyaspartates: A biodegradable alternative to currently used polycar☐ylate homo- and copolymers. Polymer Degradation and Stability. 1998, s. 39–45. doi:10.1016/S0141-3910(97)00184-5.
- ↑ a b c Adelnia Hossein. Hydrogels Based on Poly (aspartic acid): Synthesis and Applications. Frontiers in Chemistry. 2019, s. 755. doi:10.3389/fchem.2019.00755. PMID 31799235. Bibcode 2019FrCh....7..755A.
- ↑ a b Kirt W. Rusenko; Julie E. Donachy; A. P. Wheeler. Surface Reactive Peptides and Polymers. [s.l.]: ACS, 1991. Dostupné online. ISBN 9780841218864. doi:10.1021/bk-1991-0444.ch008. Kapitola Purification And Characterization Of A Shell Matrix Phosphoprotein From The American Oyster, s. 107-124.
- ↑ a b Winfried Joentgen; Nikolaus Müller; Alfred Mitschker; Holger Schmidt. Polyamides and Complex Proteinaceous Materials I. Biopolymers. 2004, s. 175–179. Dostupné v archivu pořízeném dne 2015-07-09. ISBN 9783527302222.
- ↑ Hugo Schiff. Ueber Polyaspartsäuren. Berichte der Deutschen Chemischen Gesellschaft. 1897, s. 2449–2459. doi:10.1002/cber.18970300316.
- ↑ J. Kovács; I. Könyves; Á. Pusztai. Darstellung von Polyasparaginsäuren (Polyaspartsäuren) aus dem thermischen Autokondensationsprodukt der Asparaginsäure. Experientia. 1953, s. 459–460. doi:10.1007/BF02165821. PMID 13127859.
- ↑ J. Kovács; I. Könyves. Uber DL-α,β-Polyasparaginsäure. Naturwissenschaften. 1954, s. 333. doi:10.1007/BF00644501. Bibcode 1954NW.....41..333K.
- ↑ G. D. Bennett. A Green Polymerization of Aspartic Acid for the Undergraduate Organic Laboratory. Journal of Chemical Education. 2005, s. 1380–1381. doi:10.1021/ed082p1380. Bibcode 2005JChEd..82.1380B.
- ↑ Kim C. Low; A. P. Wheeler; Larry P. Koskan. A Green Polymerization of Aspartic Acid for the Undergraduate Organic Laboratory. Hydrophilic Polymers. 1996, s. 99–111. Dostupné online. ISBN 9780841231337. doi:10.1021/ba-1996-0248.ch006.
- ↑ H. Pivcova; V. Saudek; J. Drobnik; J. Vlasak. NMR Study of Poly(aspartic acid). I. α-and β-Peptide Bonds in Poly(aspartic acid) Prepared by Thermal Polycondensation. Biopolymers. 1981, s. 1605–1614. doi:10.1002/bip.1981.360200804.
- ↑ Etso Kokufuta; Shinnichiro Suzuki; Kaoru Harad. Temperature Effect on the Molecular Weight and the Optical Purity of Anhydropolyaspartic Acid Prepared by Thermal Polycondensation. Bulletin of the Chemical Society of Japan. 1978, s. 1555–1556. doi:10.1246/bcsj.51.1555.
- ↑ Takeshi Nakato; Atsushi Kusuno; Toyoji Kakuchi. Synthesis of poly(succinimide) by bulk polycondensation of L-aspartic acid with an acid catalyst. Journal of Polymer Science Part A: Polymer Chemistry. 2000, s. 117–122. doi:10.1002/(SICI)1099-0518(20000101)38:1<117::AID-POLA15>3.0.CO;2-F. Bibcode 2000JPoSA..38..117N.
- ↑ Yaquan Wang; Yongjiang Hou; Gang Ruan; Ming Pan; Tengfei Liu. Study on the polymerization of aspartic acid catalyzed by phosphoric acid. Journal of Macromolecular Science-Pure and Applied Chemistry. 2003, s. 293–307. doi:10.1081/MA-120018116.
- ↑ Espacenet – search results. worldwide.espacenet.com [online]. [cit. 2023-02-20]. Dostupné online.[nedostupný zdroj]
- ↑ Vanga S. Rao; Philippe Lapointe; Donald N. McGregor. Temperature Effect on the Molecular Weight and the Optical Purity of Anhydropolyaspartic Acid Prepared by Thermal Polycondensation. Makromolekulare Chemie-Macromolecular Chemistry and Physics. 1993, s. 1095–1104. doi:10.1002/macp.1993.021940405.
- ↑ V. Saudek; H. Pivcova; J. Drobnik. NMR Study of Poly(aspartic acid). II. α-and β-Peptide Bonds in Poly(aspartic acid) Prepared by Common Methods. Biopolymers. 1981, s. 1615–1623. doi:10.1002/bip.1981.360200805.
- ↑ Yasuyuki Soeda; Kazunobu Toshima; Shuichi Matsuma. Sustainable enzymatic preparation of polyaspartate using a bacterial protease. Biomacromolecules. 2003, s. 193–203. doi:10.1021/bm0200534. PMID 12625712.
- ↑ Richard A. Gross; Bhanu Kalra. Biodegradable Polymers for the Environment. Science. 2002, s. 803–807. Dostupné online. doi:10.1126/science.297.5582.803. PMID 12161646. Bibcode 2002Sci...297..803G.
- ↑ David Hasson; Hilla Shemer; Alexander Sher. State of the Art of Friendly "Green" Scale Control Inhibitors: A Review Article. Industrial & Engineering Chemistry Research. 2011, s. 7601–7607. doi:10.1021/ie200370v.
- ↑ K. C. Low; A. P. Wheeler; L. P. Koskan. Commercial poly(aspartic acid) and Its Uses. Advances in Chemistry. 1996.
- ↑ Sunita M. Thombre; Bhimaro D. Sarwade. Synthesis and Biodegradability of Polyaspartic Acid: A Critical Review. Journal of Macromolecular Science, Part A. 2005, s. 1299–1315. Dostupné online. doi:10.1080/10601320500189604.
- ↑ R. A. Gross; B. Kalra. Biodegradable Polymers for the Environment. Science. 2002, s. 803–807. Dostupné online. doi:10.1126/science.297.5582.803. PMID 12161646. Bibcode 2002Sci...297..803G.
- ↑ Presidential Green Chemistry Challenge Awards: 1996 Small Business Award: Donlar Corporation [online]. United States Environmental Protection Agency. Dostupné online.
- ↑ Hossein Adelnia; Idriss Blakey; Peter J. Little; Hang T. Ta. Hydrogels Based on Poly(aspartic acid): Synthesis and Applications. Frontiers in Chemistry. 2019, s. 755. ISSN 2296-2646. doi:10.3389/fchem.2019.00755. PMID 31799235. Bibcode 2019FrCh....7..755A.
- ↑ M. J. Zahuriaan-Mehr; A. Pourjavadi; H. Salimi; M. Kurdtabar. Protein- and homo poly(amino acid)-based hydrogels with super-swelling properties. Polymers for Advanced Technologies. 2009, s. 655–671. doi:10.1002/pat.1395.
Související články
- Polyaspartátové estery