Mukaijamova hydratace
Mukaijamova hydratace je organická reakce, při které se navazuje voda na alken za přítomnosti bis(acetylacetonáto)kobaltnatého komplexu, fenylsilanu, a vzdušného kyslíku; vytváří se přitom alkohol s Markovnikovovou selektivitou.[1]
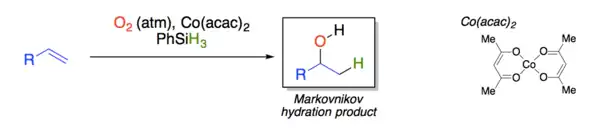
Tuto reakci vyvinul Teruaki Mukaijama na základě předchozího výzkumu selektivních hydratací alkenů katalyzovaných komplexy kobaltu se Schiffovými zásadami[2] a porfyriny.[3]
Díky své chemoselektivitě a mírným reakčním podmínkám (probíhají na vzduchu a za pokojové teploty) se Mukaijamovy hydratace staly užitečnými pro organickou syntézu.
Mechanismus
Ve svém původním článku navrhl Mukaijama mechanismus zahrnující adukt kobaltnatého peroxidu jako meziprodukt. Výměna kovu mezi hydrosilanem a peroxidem poté měla vést k silylperoxidu, který se redukcí sloučeninou kobaltu měnil na alkohol.
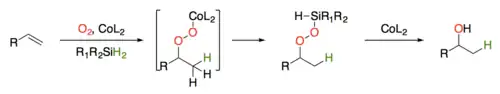
Studie mechanismu kobaltem katalyzovaných peroxidací alkenů podporují předpoklad tvorby hydridu kovu, který přímo reaguje s alkenem za vzniku přechodné vazby kobalt-alkyl, následně má homolýzou vznikat uhlíkatý radikál, jenž se přímo oxiduje kyslíkem a poté je zachycen kobaltnatou sloučeninou, přičemž se utváří Co-peroxidový meziprodukt.[4]
Výměnou kovu s hydrosilanem vzniká silylperoxid a další redukcí (homolýzou vazby kyslík-kyslík) alkohol. Použití silanu jako redukčního činidla umožňuje provést reakci bez zahřívání.[5] U méně reaktivních substrátů lze reakci urychlit přidáním terc-butylhydroperoxidu, který vyvolá oxidaci kobaltnatého komplexu na alkylperoxo-kobaltitý, jenž se poté podílí na rychlé výměně kovu s hydrosilanem a vytvoří aktivní kobaltitý hydrid.[6]
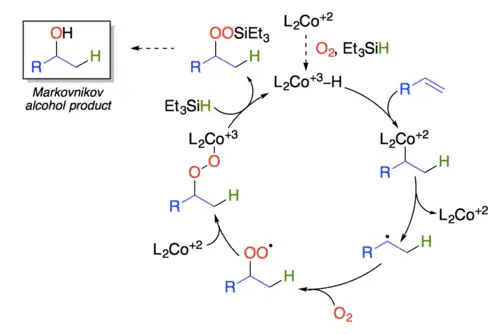
Tento mechanismus je v rozporu s dříve navrženými, které předpokládají přímé navazování Co-peroxykomplexu na alkeny.[2]
Novější výzkum naznačuje, že Mukaijamovy hydratace probíhají podobně jako přesuny vodíkových atomů z hydridů kovů; k tomuto zjištění došlo při zkoumání hydrogenací antracenů syntézním plynem.[7]
Obměny
Vytváření vazeb uhlík-kyslík
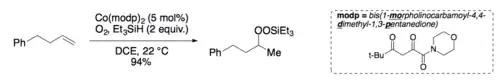
Použitá rozpouštědla a kobalt-beta-diketonátové ligandy mohou mít vliv na výtěžnost a rozdělení produktů reakce.[8]


Silylperoxidový meziprodukt je možné izolovat.[6][9]
Reakcí silylperoxidu s koncentrovanou HCl v methanolu se vytváří hydroperoxid.
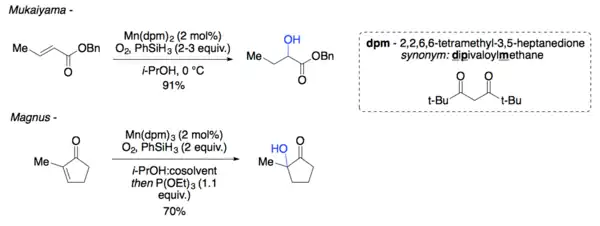
Popsána byla také hydroxylace α-enonu s využitím Mn(dpm)x za přítomnosti kyslíku a fenylsilanu.[10][11]
V roce 2004 byla popsána asymetrická varianta.[12]
Jiná varianta Mukaijamovy hydratace využívá jako katalyzátor šťavelan železitý, za přístupu vzduchu, a byla zapojena do totálních syntéz vinblastinu a podobných sloučenin.[13]
Vytváření vazeb uhlík-dusík
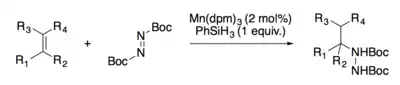
Alkeny lze hydrohydrazinovat za katalýzy sloučeninami kobaltu nebo manganu.[14][15]
Známy jsou rovněž hydroazidační reakce, katalyzované železitými komplexy.[16]
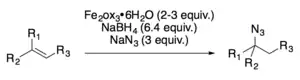
Využití
V totálních syntézách
Mukaijamovy hydratace a obdobné reakce byly zahrnuty do syntéz (±)-garsubelinu A,[17] stigmalonu,[18] vinblastinu,[13] (±)-kortistatinu A,[19] (±)-lahadininu B,[20] ouabageninu,[21] pektenotoxinu-2,[22] (±)-indoxamycinu B,[23] trichodermatidu A,[24] a (+)-omfadiolu.[25]
Na následujícím obrázku je znázorněno využití Mukaijamovy hydratace při totální syntéze (±)-garsubelinu A:
-Garsubellin_A.svg.png)
Reakce je katalyzována Co(acac)2 (acac = acetylacetonát) a probíhá na vzduchu za přítomnosti fenylsilanu, jako rozpouštědlo slouží isopropylalkohol a výtěžnost činí 73 %.
Odkazy
Reference
V tomto článku byl použit překlad textu z článku Mukaiyama hydration na anglické Wikipedii.
- ↑ Shigeru Isayama; Teruaki Mukaiyama. A New Method for Preparation of Alcohols from Olefins with Molecular Oxygen and Phenylsilane by the Use of Bis(acetylacetonato)cobalt(II). Chemistry Letters. 1989, s. 1071–1074. ISSN 0366-7022. doi:10.1246/cl.1989.1071.
- ↑ a b Dorothy E. Hamilton; Russell S. Drago; Alan Zombeck. Mechanistic studies on the cobalt(II) Schiff base catalyzed oxidation of olefins by O2. Journal of the American Chemical Society. 1987, s. 374–379. ISSN 0002-7863. doi:10.1021/ja00236a014.
- ↑ Tadashi Okamoto; Shinzaburo Oka. Oxygenation of olefins under reductive conditions. Cobalt-catalyzed selective conversion of aromatic olefins to benzylic alcohols by molecular oxygen and tetrahydroborate. The Journal of Organic Chemistry. 1984, s. 1589–1594. ISSN 0022-3263. doi:10.1021/jo00183a020.
- ↑ Takahiro Tokuyasu; Shigeki Kunikawa; Araki Masuyama; Masatomo Nojima. Co(III)−Alkyl Complex- and Co(III)−Alkylperoxo Complex-Catalyzed Triethylsilylperoxidation of Alkenes with Molecular Oxygen and Triethylsilane. Organic Letters. 2002, s. 3595–3598. Dostupné online. ISSN 1523-7060. doi:10.1021/ol0201299. PMID 12375896.
- ↑ Joshua E. Zweig; Daria E. Kim; Timothy R. Newhouse. Methods Utilizing First-Row Transition Metals in Natural Product Total Synthesis. Chemical Reviews. 2017-09-27, s. 11680–11752. ISSN 0009-2665. doi:10.1021/acs.chemrev.6b00833. PMID 28525261.
- ↑ a b Shigeru Isayama; Teruaki Mukaiyama. Novel Method for the Preparation of Triethylsilyl Peroxides from Olefins by the Reaction with Molecular Oxygen and Triethylsilane Catalyzed by Bis(1,3-diketonato)cobalt(II). Chemistry Letters. 1989, s. 573–576. ISSN 0366-7022. doi:10.1246/cl.1989.573.
- ↑ J. Halpern. Free radical mechanisms in organometallic and bioorganometallic chemistry. Pure and Applied Chemistry. 1986, s. 575–584. Dostupné online. ISSN 0033-4545. doi:10.1351/pac198658040575.
- ↑ Koji Kato; Tohru Yamada; Toshihiro Takai; Satoshi Inoki; Shigeru Isayama. Catalytic Oxidation–Reduction Hydration of Olefin with Molecular Oxygen in the Presence of Bis(1,3-diketonato)cobalt(II) Complexes. Bulletin of the Chemical Society of Japan. 1990, s. 179–186. doi:10.1246/bcsj.63.179.
- ↑ Shigeru Isayama. An Efficient Method for the Direct Peroxygenation of Various Olefinic Compounds with Molecular Oxygen and Triethylsilane Catalyzed by a Cobalt(II) Complex. Bulletin of the Chemical Society of Japan. 1990, s. 1305–1310. ISSN 0009-2673. doi:10.1246/bcsj.63.1305.
- ↑ Satoshi Inoki; Koji Kato; Shigeru Isayama; Teruaki Mukaiyama. A New and Facile Method for the Direct Preparation of α-Hydroxycarboxylic Acid Esters from α,β-Unsaturated Carboxylic Acid Esters with Molecular Oxygen and Phenylsilane Catalyzed by Bis(dipivaloylmethanato)manganese(II) Complex. Chemistry Letters. 1990, s. 1689–1872. ISSN 0366-7022. doi:10.1246/cl.1990.1869.
- ↑ Philip Magnus; Andrew H. Payne; Michael J. Waring; David A. Scott; Vince Lynch. Conversion of α,β-unsaturated ketones into α-hydroxy ketones using an MnIII catalyst, phenylsilane and dioxygen: acceleration of conjugate hydride reduction by dioxygen. Tetrahedron Letters. 2000, s. 9725–9730. doi:10.1016/S0040-4039(00)01727-5.
- ↑ Mitsuo Sato; Yasuhiko Gunji; Taketo Ikeno; Tohru Yamada. Stereoselective Preparation of α-Hydroxycarboxamide by Manganese Complex Catalyzed Hydration of α,β-Unsaturated Carboxamide with Molecular Oxygen and Phenylsilane. Chemistry Letters. 2004, s. 1304–1305. ISSN 0366-7022. doi:10.1246/cl.2004.1304.
- ↑ a b Hayato Ishikawa, David A. Colby, Shigeki Seto, Porino Va, Annie Tam, Hiroyuki Kakei, Thomas J. Rayl, Inkyu Hwang, Dale L. Boger. Total Synthesis of Vinblastine, Vincristine, Related Natural Products, and Key Structural Analogues. Journal of the American Chemical Society. 2009-04-08, s. 4904–4916. ISSN 0002-7863. doi:10.1021/ja809842b. PMID 19292450.
- ↑ Jérôme Waser; José C. González-Gómez; Hisanori Nambu; Pascal Huber; Erick M. Carreira. Cobalt-Catalyzed Hydrohydrazination of Dienes and Enynes: Access to Allylic and Propargylic Hydrazides. Organic Letters. 2005, s. 4249–4252. ISSN 1523-7060. doi:10.1021/ol0517473. PMID 16146399.
- ↑ Jérôme Waser; Erick M. Carreira. Catalytic Hydrohydrazination of a Wide Range of Alkenes with a Simple Mn Complex. Angewandte Chemie International Edition. 2004-08-06, s. 4099–4102. ISSN 1521-3773. doi:10.1002/anie.200460811. PMID 15300706.
- ↑ Erick K. Leggans; Timothy J. Barker; Katharine K. Duncan; Dale L. Boger. Iron(III)/NaBH4-Mediated Additions to Unactivated Alkenes: Synthesis of Novel 20′-Vinblastine Analogues. Organic Letters. 2012-03-16, s. 1428–1431. ISSN 1523-7060. doi:10.1021/ol300173v. PMID 22369097.
- ↑ Akiyoshi Kuramochi; Hiroyuki Usuda; Kenzo Yamatsugu; Motomu Kanai; Masakatsu Shibasaki. Total Synthesis of (±)-Garsubellin A. Journal of the American Chemical Society. 2005, s. 14200–14201. ISSN 0002-7863. doi:10.1021/ja055301t. PMID 16218611.
- ↑ Dieter Enders; André Ridder. First Asymmetric Synthesis of Stigmolone: The Fruiting Body Inducing Pheromone of the Myxobacterium Stigmatella Aurantiaca. Synthesis. 2000, s. 1848–1851. ISSN 0039-7881. doi:10.1055/s-2000-8219.
- ↑ Ryan A. Shenvi; Carlos A. Guerrero; Jun Shi; Chuang-Chuang Li; Phil S. Baran. Synthesis of (+)-Cortistatin A. Journal of the American Chemical Society. 2008, s. 7241–7243. ISSN 0002-7863. doi:10.1021/ja8023466. PMID 18479104.
- ↑ Philip Magnus; Neil Westlund. Synthesis of (±)-lahadinine B and (±)-11-methoxykopsilongine. Tetrahedron Letters. 2000-02-12, s. 9369–9372. doi:10.1016/S0040-4039(00)01399-X.
- ↑ Hans Renata; Qianghui Zhou; Phil S. Baran. Strategic Redox Relay Enables A Scalable Synthesis of Ouabagenin, A Bioactive Cardenolide. Science. 2013-01-04, s. 59–63. ISSN 0036-8075. doi:10.1126/science.1230631. PMID 23288535. Bibcode 2013Sci...339...59R.
- ↑ Dmitriy Bondar; Jian Liu; Thomas Müller; Leo A. Paquette. Pectenotoxin-2 Synthetic Studies. 2. Construction and Conjoining of ABC and DE Eastern Hemisphere Subtarget. Organic Letters. 2005, s. 1813–1816. ISSN 1523-7060. doi:10.1021/ol0504291. PMID 15844913.
- ↑ Oliver F. Jeker; Erick M. Carreira. Total Synthesis and Stereochemical Reassignment of (±)-Indoxamycin B. Angewandte Chemie International Edition. 2012-04-02, s. 3474–3477. ISSN 1521-3773. doi:10.1002/anie.201109175. PMID 22345071.
- ↑ Hiroki Shigehisa; Yoshihiro Suwa; Naho Furiya; Yuki Nakaya; Minoru Fukushima; Yusuke Ichihashi; Kou Hiroya. Stereocontrolled Synthesis of Trichodermatide A. Angewandte Chemie International Edition. 2013-03-25, s. 3646–3649. ISSN 1521-3773. doi:10.1002/anie.201210099. PMID 23417860.
- ↑ Gang Liu; Daniel Romo. Total Synthesis of (+)-Omphadiol. Angewandte Chemie International Edition. 2011-08-08, s. 7537–7540. ISSN 1521-3773. doi:10.1002/anie.201102289. PMID 21761524.