Tetrahydrofuran
| Tetrahydrofuran | |
|---|---|
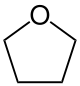 | |
| Obecné | |
| Systematický název | oxolan |
| Sumární vzorec | C4H8O |
| Vzhled | bezbarvá kapalina |
| Identifikace | |
| Registrační číslo CAS | 109-99-9 |
| PubChem | 8028 |
| ChEBI | 26911 |
| Vlastnosti | |
| Molární hmotnost | 72,11 g/mol |
| Teplota tání | −108,4 °C |
| Teplota varu | 66 °C |
| Hustota | 0,8892 6 g/cm3 |
| Viskozita | 0,48 cP |
| Struktura | |
| Dipólový moment | 1,63 D |
| Bezpečnost | |
 GHS02  GHS07  GHS08 Nebezpečí[1] | |
| R-věty | R11, R19, R36/37 |
| S-věty | S16, S29, S33 |
Některá data mohou pocházet z datové položky. | |
Tetrahydrofuran (běžně zkracovaný THF, systematicky oxolan) je nasycená pětičlenná kyslíkatá heterocyklická organická látka používaná jako polární rozpouštědlo. THF je běžně používána pro lepení PVC dílů při výrobě zdravotních prostředků jako jsou hadičkové systémy, dialyzační sety atd.
Výroba
THF se vyrábí kysele katalyzovanou dehydratací butan-1,4-diolu[2] nebo oxidací butanu na maleinanhydrid a následnou katalytickou hydrogenací.[3]
Použití jako rozpouštědlo
THF se používá jako polární aprotické rozpouštědlo, často jako alternativa diethyletheru, např. pro hydroborace nebo Grignardovy reakce. Pro takové účely je potřeba ho vysušit, protože je mísitelný s vodou. To se provádí destilací nad sušidly. Zde hrozí nebezpečí exploze, zejména při úplném vydestilování do sucha, zakoncentrováním peroxidů, které mohou vznikat reakcí THF se vzdušným kyslíkem:
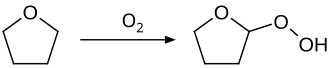
Možným řešením je nechávat vždy v destilační baňce destilační zbytek.
Nebo se THF stabilizuje komerční pomocí butylhydroxytoluenu, což minimalizuje toto riziko také.[4]
Použití jako kopolymeru
Tetrahydrofuran lze polymerovat kationtovým mechanismem za přítomnosti Lewisových kyselin za tvorby polytetrahydrofuranu, také zvaného jako poly(tetramethylen ether) glykol.

Vzniklý oligomerický polydiol (polytetrahydrofuran) společně s polyurethanem vytváří polyadičním mechanismem elastický materiál, známý jako Spandex, Lycra nebo Elastan, užívané především ve sportu.
Odkazy
Reference
- ↑ a b Tetrahydrofuran. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Herbert Müller, "Tetrahydrofuran" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a26_221
- ↑ Merck Index of Chemicals and Drugs, 9. vydání
- ↑ LI, Zhiyong; CHENG, He; LI, Junyu. Large-Scale Structures in Tetrahydrofuran–Water Mixture with a Trace Amount of Antioxidant Butylhydroxytoluene (BHT). The Journal of Physical Chemistry B. 2011-06-23, roč. 115, čís. 24, s. 7887–7895. Dostupné online [cit. 2025-05-12]. ISSN 1520-6106. doi:10.1021/jp203777g. (anglicky)
Externí odkazy
 Obrázky, zvuky či videa k tématu Tetrahydrofuran na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tetrahydrofuran na Wikimedia Commons