Vedlejší kvantové číslo
Vedlejší kvantové číslo či orbitální kvantové číslo je nezáporné celé číslo, které popisuje velikost momentu hybnosti elektronu v atomu. Jedná se o jedno ze čtyř kvantových čísel, která jednoznačně popisují stav elektronu v elektronovém obalu atomu.
Elektrony se podle hodnoty hlavního kvantového čísla řadí do tzv. elektronových slupek. Jednotlivé elektronové slupky se navzájem liší energií. Čím větší je hlavní kvantové číslo slupky, tím jsou elektrony v něm dále od jádra atomu a mají tak větší potenciální energii. Uvnitř každé elektronové slupky se vyskytuje vícero elektronů, jejichž (orbitální) momenty hybnosti se mohou lišit. Elektrony s různými momenty hybnosti se pohybují kolem jádra atomu různými způsoby a jejich dráhy mají různé tvary.
V kvantové mechanice popisujeme elektron podle pravděpodobnosti jeho výskytu v nějakém bodě a to se provádí pomocí vlnové funkce. Tvar vlnové funkce elektronu je určen hlavním, vedlejším a magnetickým kvantovým číslem. Pro různá vedlejší kvantová čísla se tvary vlnových funkcí mohou i velmi lišit.
Vedlejší kvantové číslo standardně značíme a může nabývat hodnot , kde je hlavní kvantové číslo.
Definice
V rámci kvantové mechaniky je elektron v atomu popsán pomocí tzv. vlnové funkce. Řešením Schrödingerovy rovnice lze spočítat, že vlnová funkce elektronu je popsána pomocí tzv. sférických harmonických funkcí a Laguerrových polynomů. Laguerrovy polynomy určují výskyt elektronu v radiální vzdálenosti od jádra a sférické harmoniky zase rozložení elektronů v různých směrech. Právě tyto funkce určují tvary orbitalů.[pozn. 1]
Obě tyto rodiny funkcí lze popsat pomocí dvou celočíselných parametrů, a to dvojicí pro Laguerrovy polynomy (právě tato čísla určují vzdálenost elektronu od jádra atomu) a pro sférické harmoniky. Dvojice čísel tak popisuje samotný tvar orbitalu a zase unikátně určují vzdálenost elektronu od jádra. Vedlejší kvantové číslo se nachází v obou těchto dvojicích a hraje proto významnou roli pro popis elektronu v atomu.
Při popisu atomu v kvantové mechanice mohou některé fyzikální veličiny nabývat pouze diskrétních hodnot, což nazýváme kvantování. V atomu dochází ke kvantování energií elektronů a také jejich momentů hybnosti. Právě díky kvantování momentu hybnosti je možno zavést orbitální kvantové číslo, protože jinak by (stejně jako v klasické mechanice) jeho velikost mohla být libovolné reálné číslo. Jednodušší je popis kvadrátu momentu hybnosti (druhá mocnina momentu hybnosti). Ten se kvantuje jako , kde je celé číslo a je redukovaná Planckova konstanta.[1] To zapisujeme následovně.
Zde je vlnová funkce a je operátor kvadrátu momentu hybnosti.
Elektron, který má kvantové číslo tak má kvadrát momentu hybnosti .
Charakterizace orbitalů
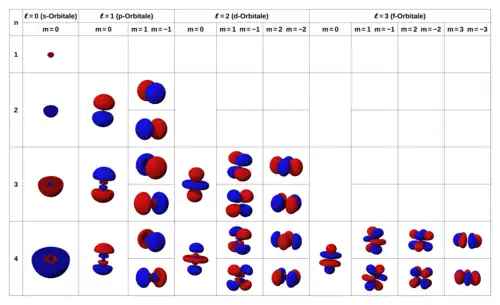
Stav elektronu v atomu je popsán pomocí čtyř kvantových čísel, z nichž tři mají vliv na rozložení jeho vlnové funkce v prostoru. Hlavní kvantové číslo určuje velikost orbitalu. Vedlejší a magnetické kvantové číslo určují jeho tvar a orientaci v prostoru. Různé způsoby prostorové rozložení elektronů v atomech nazýváme atomové orbitaly.
Hlavní kvantové číslo udává také maximální počet elektronů v elektronové slupce. Číslo může nabývat hodnot od nuly až po a magnetiské kvantové číslo může nabývat hodnot . Číslo tak může nabývat různých hodnot.
Díky Pauliho principu výlučnosti, který tvrdí, že žádné 2 elektrony nesmí mít všechna kvantová čísla stejná, můžeme spočítat, že čísla a dávají celkem
různých orbitalů. Díky spinovému kvantovému číslu jsou v každém orbitalu umístěny vždy nejvýše 2 elektrony (protože spinové číslo může nabývat dvou různých hodnot). V elektronové slupce příslušící hlavnímu číslu se tak může nacházet nejvýše elektronů.
Mluvíme tak o tom, že vedlejší kvantové číslo určuje typ atomového orbitalu. Podle čísla rozlišujeme různé typy elektronových orbitalů.
| hodnota | typ orbitalu | historický původ názvu |
|---|---|---|
| 0 | s | sharp |
| 1 | p | principal |
| 2 | d | diffuse |
| 3 | f | fundamental |
| 4 | g | následuje za f v abecedě |
Odkazy
Poznámky
- ↑ tento popis je platný pouze pro atomy podobné vodíku, kdy vzájemné interakce mezi elektrony lze zanedbat
Reference
Literatura
- KLÍMA, Jan; VELICKÝ, Bedřich. 1. vyd. Praha: Karolinum, 2015. 356 s. ISBN 978-80-246-2937-7.
- ZAMASTIL, Jaroslav; JAKUB, Benda. Kvantová mechanika a elektrodynamika. 2. vyd. Praha: Karolinum, 2021. 409 s. ISBN 978-80-246-4827-9.