Heteropolymetaláty
Heteropolymetaláty jsou polyoxometaláty obsahující tři nebo více oxoaniontů přechodných kovů propojených atomy kyslíku za vzniku trojrozměrných molekulových sítí. Oproti isopolymetalátům, obsahujících atomy jednoho kovu, jich mají více. Těmito kovy jsou nejčastěji prvky 6. skupiny (Mo, W), méně často prvky 5. skupiny (V, Nb, Ta) ve svých nejvyšších oxidačních číslech. Vzniklé sloučeniny bývají obvykle bezbarvé až oranžové a diamagnetické. Většina heteropolymetalátů obsahuje též fosforečnanové nebo křemičitanové oxoanionty; jsou ale také známy odchylky od těchto struktur.[1][2]
Struktura
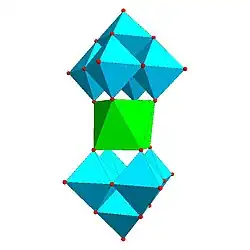
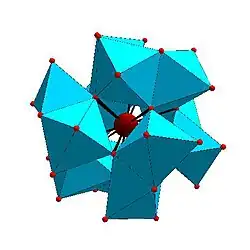
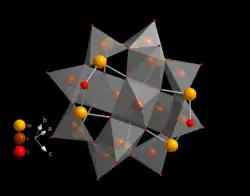
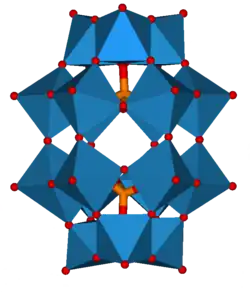
Některé druhy struktur se opakují; například Kegginův ion je běžný u molybdenanů i wolframanů s různými centrálními heteroatomy. Kegginovy a Dawsonovy struktury mají tetraedricky koordinované heteroatomy, například P nebo Si, a u Andersonových struktur je centrální atom, například hliník, oktaedrický.[3]
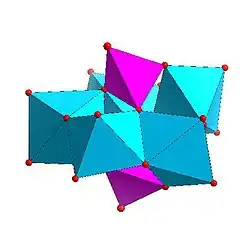
|
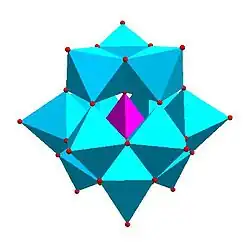
|
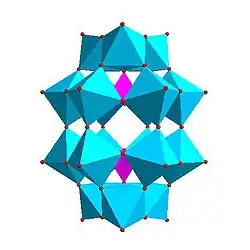
| |
| Strandbergova struktura, [HP2Mo5O23]4− | Kegginova struktura, [XM12O40]n− | Dawsonova struktura, [X2M18O62]n− | |
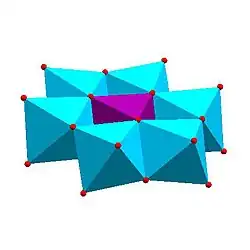
|
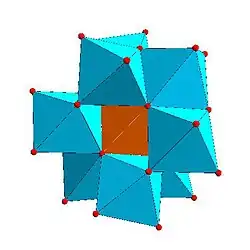
|
|
|
| Andersonova struktura, [XM6O24]n− | Allmanova–Waughova struktura, [XM9O32]n− | Weakleyova–Yamaseova struktura, [XM10O36]n− | Dexterova–Silvertonova struktura, [XM12O42]n− |
Heteropolykyseliny
Heteropolymetaláty bývají tepelně stálejší než homopolymetaláty, což je způsobeno stabilizujícími účinky tetraedrických oxoaniontů, které „slepují“ dohromady přechodné kovy a oxostruktury. Jedním z důsledků tohoto jevu je možnost izolovat je jako kyseliny, což u homopolymetalátů obvykle možné není. Patří sem například:[4]
- Kyselina křemičito-wolframová, H4SiW12O40·n H2O
- Kyselina fosfomolybdenová, H3Mo12PO40·n H2O
- Kyselina fosfowolframová, H3W12PO40·n H2O
Izomerie
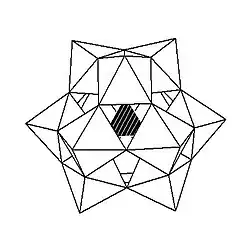
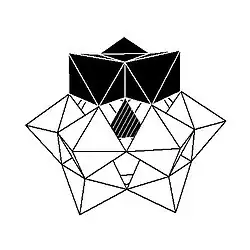
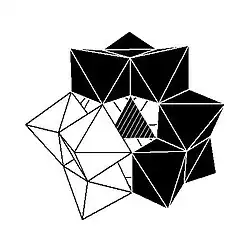
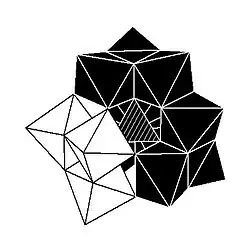
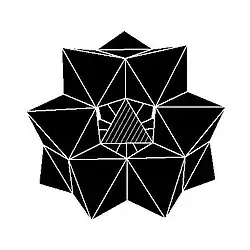
Kegginova struktura má 5 izomerů, které lze odvodit otáčeními jedné nebo více ze čtyř skupin M3O13 o 60°.
| α-[XM12O40]n− | β-[XM12O40]n− | γ-[XM12O40]n− | δ-[XM12O40]n− | ε-[XM12O40]n− |
|---|---|---|---|---|
|
|
|
|
|
Použití
Tyto kyseliny se používají jako katalyzátory.[5]
Heteropolykyseliny se běžně používají jako heterogenní a homogenní katalyzátory, často ty založené na Keginově struktuře, protože se vyznačují tepelnou stálostí, vysokou kyselostí, a výraznými oxidačními účinky.[6]
K reakcím katalyzovaným heteropolykyselinami patří:[7]
- Homogenní katalýza
- hydrolýza propenu na propan-2-ol za katalýzy H3PMo12O40 a H3PW12O40
- Prinsova reakce (H3PW12O40)
- polymerizace tetrahydrofuranu pomocí H3PW12O40
- Heterogenní katalýza
- dehydratace propan-2-olu na propen a methanolu na uhlovodíky za přítomnosti H3PW12O40
- přeměna hexanu na 2-methylpentan (isohexan) za katalýzy H3PW12O40 na SiO2
- Homogenní oxidace
- cyklohexen + H2O2 na kyselinu adipovou za přítomnosti H3PMo6V6O40
- ketony + O2 na kyseliny a aldehydy za přítomnosti H3PMo6V6O40
Reference
V tomto článku byl použit překlad textu z článku Heteropolymetalate na anglické Wikipedii.
- ↑ N. N. Greenwood; A. Earnshaw. Chemistry of the Elements. Oxford: Butterworth-Heinemann, 1997. ISBN 978-0-7506-3365-9.
- ↑ M. T. Pope. Heteropoly and Isopoly Oxometalates. New York: Springer, 1983.
- ↑ Amir Blazevic; Annette Rompel. The Anderson–Evans polyoxometalate: From inorganic building blocks via hybrid organic–inorganic structures to tomorrows "Bio-POM". Coordination Chemistry Reviews. 2016, s. 42–64. doi:10.1016/j.ccr.2015.07.001.
- ↑ J. A. Dias; S. C. L. Dias; E. Caliman. Keggin Structure Polyoxoometalates. Inorganic Syntheses. 2014, s. 210–217. ISBN 9781118744994. doi:10.1002/9781118744994.ch39.
- ↑ Noritaka Mizuno; Makoto Misono. Heterogeneous Catalysis. Chemical Reviews. 1998, s. 199–217. doi:10.1021/cr960401q. PMID 1185150.
- ↑ KOZHEVNIKOV, Ivan V. Catalysis by Heteropoly Acids and Multicomponent Polyoxometalates in Liquid-Phase Reactions. Chemical Reviews. 1998-02-01, roč. 98, čís. 1, s. 171–198. Dostupné online [cit. 2025-04-06]. ISSN 0009-2665. doi:10.1021/cr960400y. (anglicky)
- ↑ "Oxide catalysts in solid state chemistry". T Okuhara, M Misono. Encyclopedia of Inorganic Chemistry. Editor R Bruce King (1994). John Wiley and Sons ISBN 0-471-93620-0